-
路透社2017年1月26日报道称,美国科学家给氢施加极强的压力,使之变成金属氢,从而制造出一种全新具有金属性能的材料。下列有关金属氢的说法错误的是
A. 金属氢具有导电性 B. 金属氢中存在氢键
C. 氢气与金属氢是同素异形体 D. 金属氢是高储能物质
难度: 中等查看答案及解析
-
下列叙述中正确的是
A.
的一氯代物有5种
B. 将浓硝酸、稀硫酸和苯混合加热可制得硝基苯
C. 乙烯能使酸性KMn04和溴水褪色,但反应原理不同
D. 糖类、蛋白质、油脂在一定条件下均可以发生水解反应
难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数的值,下列有关叙述正确的是
A. 在2L0.2mol/L的Na2CO3溶液中,阴离子总数小于0.4NA
B. 在标准状况下,3.36LS03含有的电子数为6NA
C. 将0.5molNH4N03溶于稀氨水中使溶液呈中性,溶液中NH4+数目为0.5NA
D. 密闭容器中lmolNO和0.5molO2充分反应,产物的分子数为NA
难度: 中等查看答案及解析
-
Ge的氧化物在一定条件下有如下转化。已知0<n<2,下列说法正确的是
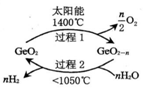
A. 化学能最终转变为太阳能
B. 温度低于1050℃时,CeO2比CeO2-n稳定
C. 在过程l中CeO2只起还原剂的作用
D. 两步反应均属于分解反应
难度: 中等查看答案及解析
-
元素X、Y、Z的原子序数依次增大,且序数之和为36。Y、Z在同一周期,X、Z在同一主族,X原子最外层电子数是Y原子最外层电子数的3倍。下列说法正确的是
A. Y的单质不与水反应
B. Z的最高价氧化物对应的水化物不稳定
C. 简单离子的半径由大到小为Y>Z>X
D. 由X、Y、Z三种元素形成的化合物里含有离子键
难度: 中等查看答案及解析
-
下列实验操作、现象和所得出的结论均正确的是
选项
实验
现象
结论
A
向盛有少量Na2O2固体的试管中加入一定量蒸馏水,再滴加酚酞试液
溶液先变红后褪色
过程中可能产生了H2O2
B
用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔,在酒精灯上加热
熔化后的液态铝滴落下来
金属铝的熔点较低
C
在X溶液中加入Ba(N03)2溶液
有白色沉淀生成
X中一定含有SO42-
D
取少量淀粉于试管中,加入稀硫酸后加热片刻,冷却后取清液,加入新制Cu(OH)2,再加热煮沸
未见红色沉淀
淀粉未发生水解
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
已知:25℃时,某些弱酸的电离平衡常数如下表。下列说法正确的是

A. 向漂白粉溶液中加入少量NaHSO3可增强漂白性
B. Na2CO3溶液中通入少量SO2发生反应的离子方程式为:2C032-+SO2+H2O=2HCO3-+S032-
C. 相同浓度的NaC1O、Na2CO3、NaHCO3溶液的pH值由大到小的顺序为:NaC10>Na2C03>NaHC03
D. 相同浓度的CH3COONa和NaClO溶液混合后,溶液中各离子浓度大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
难度: 困难查看答案及解析
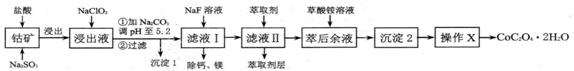


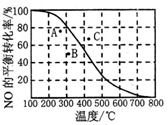
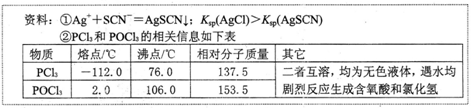
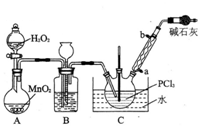
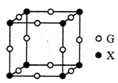
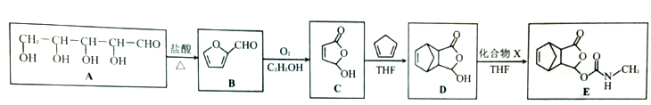
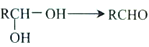 。
。