-
2015年7月31日,中国获得2022年冬奥会主办权,这将促进中国冰雪运动。以下关于冰的说法正确的是
A.冰与水共存物属于混合物 B.冰的密度比水大
C.冰与二氧化硅的晶体类型相似 D.氢键在冰晶体结构中起关键作用
难度: 简单查看答案及解析
-
下列化学用语中,正确的是
A.乙炔的结构简式 CHCH
B.乙醇的比例模型

C.NaCl的电子式
D.S原子结构示意图
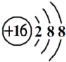
难度: 简单查看答案及解析
-
下列说法正确的是
A.煤的主要组成为苯以及苯的同系物
B.“可燃冰”为水可能变成油提供了有力的证据
C.油脂、淀粉、纤维素、蛋白质都是高分子化合物
D.石油的裂解是使石油分馏产物中的长链烃断裂成乙烯、丙烯等气态短链烃
难度: 简单查看答案及解析
-
用14C标记的一种C60羧酸衍生物,在特定条件下会断裂DNA抑制艾滋病毒的繁殖。以下有关14C的叙述正确的是
A.与12C60的碳原子化学性质不同 B.与15N含的中子数相同
C.与12C60互为同素异形体 D.与12C、13C互为同系物
难度: 中等查看答案及解析
-
下列过程中,共价键被破坏的是
A.碘升华 B.NaOH熔化 C.NaHSO4溶于水 D.酒精溶于水
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数,下列叙述正确的是
A.l mol甲基(-CH3)含有9 NA个电子
B.标准状况下,22.4 L SO3含有的原子数为4NA
C.0.10 mol·L-1 NaOH溶液中含有OH-离子数是0.1NA
D.5.6 g Fe与2.24 L Cl2充分反应转移电子数为0.2NA
难度: 中等查看答案及解析
-
下列关于金属腐蚀的叙述正确的是
A.金属(M表示金属) 被腐蚀的本质是: M n+ + ne- = M
B.金属不可能在碱性环境中发生电化学腐蚀
C.镀锌铁的镀层破损后,镀层仍能对铁起保护作用
D.钢管与外加直流电源的正极相连,以保护它不受腐蚀
难度: 中等查看答案及解析
-
用0.1000mol·L-1标准NaOH溶液测定食醋中醋酸的含量,下列说法正确的是
A.酸式滴定管、碱式滴定管及锥形瓶均需洗净后再润洗内壁2~3次
B.可使用酚酞或甲基橙作指示剂
C.滴定过程中眼睛应始终注视滴定管内液面变化
D.读取标准液的刻度时,滴定前平视,滴定后仰视,测定结果偏高
难度: 中等查看答案及解析
-
下列说法中正确的是
A.苯使溴水层褪色属于加成反应
B.乙烯与水反应生成乙醇属于水解反应
C.间二甲苯只有一种结构说明苯分子中不存在单双键交替
D.等质量环丁烷(C4H8)和乙烯(C2H4) 完全燃烧,消耗的氧气量相等
难度: 中等查看答案及解析
-
下列褪色现象中,其中一项与其他三项褪色原理不同的是
A.二氧化硫能使酸性高锰酸钾溶液褪色
B.氯水能使甲基橙褪色
C.浓硝酸能使石蕊试液褪色
D.臭氧能使品红溶液褪色
难度: 中等查看答案及解析
-
下列用水能鉴别的一组物质是
A.乙酸乙酯、甘油、硝基苯 B.乙醇、甘油、四氯化碳
C.乙酸乙酯、苯、乙醇 D.苯、四氯化碳、硝基苯
难度: 中等查看答案及解析
-
下列说法正确的是
A.Cu与石墨都能导电,但都属于非电解质
B.AgCl与BaSO4都是难溶性盐,但都属于强电解质
C.SO2与CaO都是氧化物,因此SO2、CaO都是非电解质
D.NaCl与HCl都是电解质,因此熔融NaCl、液态HCl都能导电
难度: 中等查看答案及解析
-
原子序数依次增大的四种短周期元素X、Y、Z、M。其中Z是金属元素,X的原子半径小于Y ,Y与M同主族,Y的质子数为M的1/2。下列说法一定正确的是
A.X与M的原子序数之差为31
B.Y的离子半径小于Z的离子半径
C.由X与Z组成的化合物,可与水反应放出X2
D.由M与Y组成的化合物,其水化物是强酸
难度: 中等查看答案及解析
-
一定条件下,反应:C(s)+CO2(g)
2CO(g),ΔH>0在2L恒容密闭容器中进行,反应进行20s时,CO的物质的量增加了0.40 mol,则下列说法正确的是
A.反应20s,C的平均反应速率v (C) =0. 005 mol·L-1·s-1
B.反应平衡时,v (CO2): v (CO) =1:2
C.升高温度时,正反应速率增大,逆反应速率减小
D.充入N2使体系压强增大,能提高反应速率
难度: 中等查看答案及解析
-
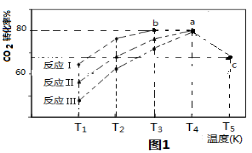
H2O2(l)在有MnO2条件下和无MnO2条件下分解的能量变化如图所示。下列说法正确是
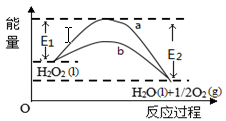
A.有MnO2条件下的反应曲线是a曲线
B.a曲线变为b曲线,反应的活化分子百分数增大
C.a曲线变为b曲线,平衡时H2O2的转化率增大
D.b曲线的热化学方程式为:H2O2(l) =H2O(l) +1/2O2(g) ΔH= - ( E1 - E2 )KJ •mol-1
难度: 中等查看答案及解析
-
用pH传感器测得0.10mol·L-1Na2CO3溶液从55℃升高至85℃的pH如图所示。在55℃升高至85℃升温过程中,下列说法正确的是
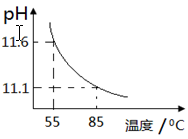
A. c(H+)增大,c(OH-)减小
B.c(CO32-)/c(HCO3-)比值不断增大
C.c(CO
)+c(HCO3-) +c(H2CO3)=0.10
D.c(OH-) - c(HCO3-) - c(H2CO3)=10-11.1
难度: 中等查看答案及解析
-
为完成相应实验,实验器材(规格和数量不限)足够的一项是
相应实验
实验器材(省略夹持装置)
A
氯化钠溶液的浓缩结晶
烧杯、玻璃棒、酒精灯
B
用盐酸除去硫酸钡中的少量碳酸钡
烧杯、漏斗、胶头滴管、滤纸
C
用浓硫酸配制0.5mol·L-1的溶液
烧杯、玻璃棒、胶头滴管、容量瓶
D
用溴水和CCl4除去NaBr溶液中的少量NaI
烧杯、玻璃棒、胶头滴管、分液漏斗
难度: 中等查看答案及解析
-
装置(Ⅰ)为铁镍(Fe-Ni)可充电电池:Fe+NiO2+2H2O
Fe(OH)2+Ni(OH)2;装置(Ⅱ)为电解示意图。当闭合开关K时,Y附近溶液先变红。下列说法正确的是
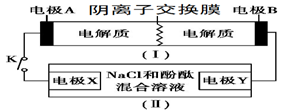
A.闭合K时,X的电极反应式为:2H++2e-= H2↑
B.闭合K时,A电极反应式为:NiO2+2e-+2H+= Ni(OH)2
C.给装置(Ⅰ)充电时,B极参与反应的物质被氧化
D.给装置(Ⅰ)充电时,OH- 通过阴离子交换膜,移向A电极
难度: 困难查看答案及解析
-
已知部分弱酸的电离平衡常数如下表:
弱酸
醋酸
次氯酸
碳酸
亚硫酸
电离平衡常数(25℃)
Ka=1.75×10-5
Ka=2.98×10-8
Ka1=4.30×10-7
Ka2=5.61×10-11
Ka1=1.54×10-2
Ka2=1.02×10-7
下列离子方程式正确的是
A.少量CO2通入NaClO溶液中:CO2+H2O+2ClO-=CO
+2HClO
B.少量的SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO
C.少量的SO2通入Na2CO3溶液中:SO2+H2O+2 CO
=SO
+2HCO3-
D.相同浓度NaHCO3溶液与NaHSO3溶液等体积混合:H++HCO3-=CO2↑+H2O
难度: 困难查看答案及解析
-
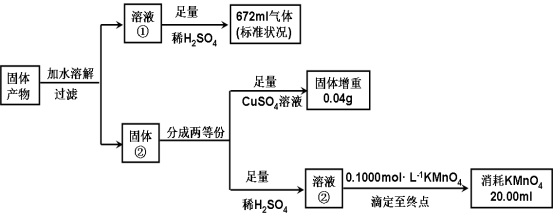
某种溶液只含下表离子中的几种(不考虑水的电离与离子水解),且各种离子的物质的量浓度均为0.1 mol·L-1。
阳离子
K+ NH4+ Fe2+ Mg2+ Al3+ Cu2+
阴离子
OH- Cl- AlO
CO
SO
SiO
某同学进行了如下实验(必要时可加热):
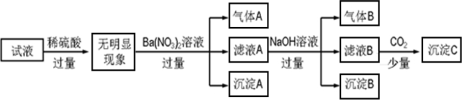
下列说法正确的是
A.原溶液中只含有NH4+、Fe2+、Cl-、SO
B.由沉淀A推断原溶液中一定含有SO
C.滤液A中可能含有K+、Al3+、Cl-
D.沉淀B中一定含有Mg(OH)2
难度: 极难查看答案及解析
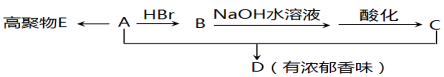

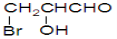 D.
D.