-
下列说法正确的是 ( )。
A.凡是中心原子采取sp3杂化的分子,其立体构型都是正四面体型
B.在SCl2中,中心原子S采取sp杂化轨道成键
C.杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子对
D.凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.σ键比π键重叠程度大,形成的共价键强
B.两个原子之间形成共价键时,最多有一个σ键
C.气体单质中,一定有σ键,可能有π键
D.N2分子中有一个σ键,2个π键
难度: 中等查看答案及解析
-
在半导体生产或灭火剂的使用中,会向空气逸出气体如:NF3、CHClFCF3、C3F8,它们虽是微量的,有些确是强温室气体。下列推测不正确的是 ( )
A.由价层电子对互斥理论可确定NF3分子呈三角锥型
B.C3F8在CCl4中的溶解度比水中大
C.CHClFCF3存在手性异构
D.第一电离能:N<O<F
难度: 中等查看答案及解析
-
关于晶体的下列说法正确的是 ( )
A.只要含有金属阳离子的晶体就一定是离子晶体
B.离子晶体中一定含金属阳离子
C.在共价化合物分子中各原子都形成8电子稳定结构
D.分子晶体的熔点不一定比金属晶体的熔点低
难度: 中等查看答案及解析
-
下列对晶体类型判断正确的是( )
选项
Na2B2O7
CaF2
H3BO3
NH3
A
原子晶体
金属晶体
原子晶体
分子晶体
B
离子晶体
分子晶体
离子晶体
分子晶体
C
离子晶体
离子晶体
分子晶体
分子晶体
D
分子晶体
离子晶体
分子晶体
离子晶体
难度: 中等查看答案及解析
-
下列物质的结构或性质与氢键无关的是
A.乙醚的沸点 B.乙醇在水中的溶解度
C.对羟基苯甲醛的沸点 D.DNA的双螺旋结构
难度: 简单查看答案及解析
-
某晶体中含有极性键,关于该晶体的说法错误的是( )
A.不可能有很高的熔沸点 B.不可能是金属晶体
C.可能是有机物 D.可能是离子晶体
难度: 中等查看答案及解析
-
下列晶体分类中正确的一组是 ( )。
选项
离子晶体
原子晶体
分子晶体
A
NaOH
Ar
SO2
B
K2SO4
石墨
S
C
CH3COONa
水晶
D
Ba(OH)2
金刚石
玻璃
难度: 中等查看答案及解析
-
下列各组物质熔化或升华时,所克服的粒子间作用属于同种类型的是( )
A.Na2O和SiO2熔化 B.碘和干冰升华
C.氯化钠和蔗糖熔化 D.Mg和S熔化
难度: 中等查看答案及解析
-
关于晶体的叙述中,正确的是 ( )
A.原子晶体中,共价键的键能越大,熔、沸点越高
B.分子晶体中,分子间的作用力越大,该分子越稳定
C.分子晶体中,共价键的键能越大,熔、沸点越高
D.某晶体溶于水后,可电离出自由移动的离子,该晶体一定是离子晶体
难度: 中等查看答案及解析
-
下列说法正确的是(NA为阿伏加德罗常数) ( )
A.124 g P4中含有P—P键的个数为4NA
B.12 g石墨中含有C—C键的个数为1.5NA
C.12 g金刚石中含有C—C键的个数为4NA
D.60 g SiO2中含有Si—O键的个数为2NA
难度: 中等查看答案及解析
-
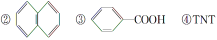
下列物质中存在配位键的是( )
①H3O+ ②[B(OH)4]- ③CH3COO- ④NH3 ⑤CH4
A.①② B.①③ C.④⑤ D.②④
难度: 中等查看答案及解析
-
X和Y两种元素的核电荷数之和为22,X的原子核外电子数比Y的少6个。下列说法中不正确的是 ( )
A.X的单质固态时为分子晶体
B.Y的单质为原子晶体
C.X与Y形成的化合物固态时为分子晶体
D.X与碳形成的化合物为分子晶体
难度: 中等查看答案及解析
-
下列各组物质中,按熔点由低到高的顺序排列正确的是( )
①Na、K、Rb ②CO、KCl、SiO2 ③O2、I2、Hg ④Na、Mg、Al
A.①③ B.①④ C.②③ D.②④
难度: 中等查看答案及解析
-
离子晶体稳定性取决于晶体中晶格能的大小。判断KCl、NaCl、CaO、BaO四种晶体稳定性由高到低的顺序是 ( )
A.KCl>NaCl>BaO>CaO B.NaCl>KCl>CaO>BaO
C.CaO>BaO>NaCl>KCl D.CaO>BaO>KCl>NaCl
难度: 中等查看答案及解析
-
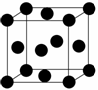
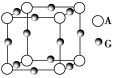
某晶体的一部分如图所示,这种晶体中A、B、C三种粒子数之比是 ( )
A.3∶9∶4 B.1∶4∶2 C.2∶9∶4 D.3∶8∶4
难度: 中等查看答案及解析
-
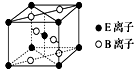
右图是由Q、R、G三种元素组成的一种高温超导体的晶胞结构,其中R为+2价,G为-2价,则Q的化合价为( )
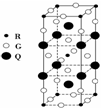
A. -2 B. +2 C. +3 D. -3
难度: 困难查看答案及解析
-
下列图像是NaCl、CsCl、ZnS等离子晶体结构图或是从其中分割出来的部分结构图。试判断属于NaCl的晶体结构的图像为 ( )

难度: 中等查看答案及解析
-
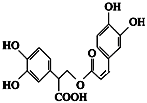
正硼酸(H3BO3)是一种片层状结构白色晶体,层内的H3BO3分子通过氢键相连(如下图)。下列有关说法正确的是 ( )
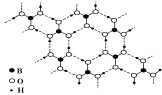
A.正硼酸晶体属于原子晶体
B.H3BO3分子的稳定性与氢键有关
C.分子中硼原子最外层为8电子稳定结构
D.含1 mol H3BO3的晶体中有3 mol氢键
难度: 中等查看答案及解析
-
近年来,科学家合成一系列具有独特化学特性的氢铝化合物(AlH3)n。已知,最简单的氢铝化合物Al2H6的球棍模型如下图所示,它的熔点为150 ℃,燃烧热极高。下列说法肯定错误的是( )
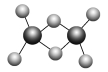
A.Al2H6在固态时所形成的晶体是分子晶体
B.Al2H6在空气中完全燃烧,产物为氧化铝和水
C.氢铝化合物可能成为未来的储氢材料和火箭燃料
D.氢铝化合物中可能存在组成为AlnH2n+2的一系列物质(n为正整数)
难度: 困难查看答案及解析
-
下列说法正确的是( )
A.由于铵盐是由离子键构成的,因而化学性质相当稳定
B.分子晶体中都存在分子间作用力,但可能不存在共价键
C.在常见的四种晶体类型中,都有“原子(离子)半径越大,物质熔点越低”的规律
D.常温下为气态或液态的物质,其固态时一定会形成分子晶体
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.离子晶体中,只存在离子键,不可能存在其它化学键
B.氧族元素(O、S、Se、Te)的氢化物的沸点依次升高
C.NaHSO4、Na2O2晶体中的阴阳离子个数比均为1∶1
D.晶体的硬度:金刚石>碳化硅>石英
难度: 中等查看答案及解析
-
如图是氯化铯晶体的晶胞,已知晶体中2个最近的Cs+离子核间距为a cm,氯化铯的摩尔质量为M,则氯化铯晶体的密度为d g·cm-3,阿伏加德罗常数的值可表示为( )
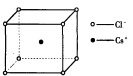
A.2Ma3d B.M/(a3d) C.M/(2a3d) D.2M/(a3d)
难度: 困难查看答案及解析
-
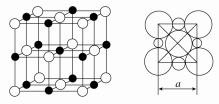
有一种蓝色晶体[可表示为:MxFey(CN)6],经X射线研究发现,它的结构特征是Fe3+和Fe2+互相占据立方体互不相邻的顶点,而CN-位于立方体的棱上。其晶体中阴离子的最小结构单元如图所示。下列说法正确的是 ( )。
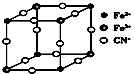
A.该晶体属于分子晶体,化学式为MFe2(CN)6
B.该晶体属于离子晶体,M呈+1价
C.该晶体属于离子晶体,M呈+2价
D.晶体中与每个Fe3+距离最近且等距离的CN-为12个
难度: 困难查看答案及解析
-
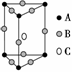
CaC2晶体的晶胞结构与NaCl晶体的相似(如下图所示),但CaC2晶体中由于哑铃形C22-的存在,使晶胞沿一个方向拉长。下列关于CaC2晶体的说法中正确的是( )

A.1个Ca2+周围距离最近且等距离的C22-数目为6
B.该晶体中的阴离子与F2是等电子体
C.6.4克CaC2晶体中含阴离子0.1mol
D.与每个Ca2+距离相等且最近的Ca2+共有12个
难度: 困难查看答案及解析