-
图表资料可以为我们提供很多信息.下列从图表中获取的信息或相关应用不正确的是( )
A.从元素周期表中查找元素的原子序数、元素符号、相对原子质量
B.根据金属元素在地壳中的含量图,判断人类开发和使用金属的年代
C.根据金属活动性顺序表,判断金属材料是否容易被盐酸腐蚀
D.根据溶解度曲线图,选择从溶液中获得晶体的方法难度: 中等查看答案及解析
-
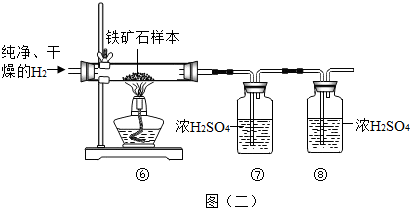
下列各实验不能达到实验目的是( )
A.用燃着的木条鉴别二氧化碳和氧气
B.加入适量的澄清的石灰水,以除去Ca(NO3)2溶液中的HNO3
C.用生石灰除去氢气中混有的水蒸气
D.用碳酸钠溶液鉴别澄清石灰水和Ba(OH)2溶液难度: 中等查看答案及解析
-
欲将粗盐提纯并用所得精盐配制一定溶质质量分数的氯化钠溶液.下列说法正确的是( )
A.过滤时,用玻璃棒在漏斗中搅拌加快过滤速度
B.蒸发滤液时,待蒸发皿中滤液蒸干时才停止加热
C.用精盐配制上述溶液需要经过计算、称量、溶解、装瓶贴标签等步骤
D.配制溶液时必须使用的仪器有托盘天平、酒精灯、量筒、试管、玻璃棒等难度: 中等查看答案及解析
-
“神州七号”飞船返回舱进入大气层时会摩擦产生高温,其外表材料在高温时会发生下列变化带走热量,从而降低飞船温度,保证飞行员的安全.这些变化中属于化学变化的是( )
A.汽化
B.蒸发
C.升华
D.分解难度: 中等查看答案及解析
-
一般说来,大多数作物适宜在中性或接近中性的土壤中生长.经测定某土壤的pH为5.5,要改良它,应在土壤中施加适量的( )
A.氢氧化钠
B.熟石灰
C.食盐
D.盐酸难度: 中等查看答案及解析
-
银杏叶、果是防治高血压、心脏病重要的医药原料,银杏叶中提取物可以“捍卫心脏,保护大脑”.下列银杏生长过程中所施肥料属于复合肥的是( )
A.KH2PO4
B.CO(NH2)2
C.K2SO4
D.CaSO4、Ca(H2PO4)2难度: 中等查看答案及解析
-
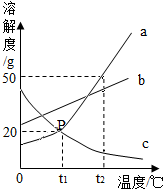
下列有关叙述中,正确的是( )
A.20℃,100g水中溶解30gNaCl,所以20℃时NaCl的溶解度是30g
B.NH4NO3固体溶于水,吸收热量
C.饱和溶液降温后,都有溶质析出
D.KNO3的饱和溶液一定比不饱和溶液浓难度: 中等查看答案及解析
-
我国首部《食品安全法》将于今年6月1日颁布实施.下列做法能保证食品安全的是( )
A.真空包装食品
B.沥青公路上晒粮食
C.给橙子“打蜡上色”
D.用工业酒精勾兑饮用酒难度: 中等查看答案及解析
-
钾是人体必需的元素之一,若血液中钾元素含量偏低,易引发低钾血症,严重时会引发心率失常,甚至猝死.医学专家提醒:应重视日常补钾.可以服用的某种钾的化合物,其水溶液可以和硝酸银溶液反应,生成不溶于稀硝酸的白色沉淀.此化合物是( )
A.KCl
B.K2CO3
C.KNO3
D.KOH难度: 中等查看答案及解析
-
利用无色酚酞试剂就能鉴别的一组溶液是( )
A.BaCl2、H2SO4、HCl
B.NaOH、KOH、HCl
C.K2CO3、Na2CO3、KCl
D.NaCl、NaOH、HCl难度: 中等查看答案及解析
-
下列属于有机高分子化合物的是( )
A.乙烯
B.淀粉
C.尿素
D.葡萄糖难度: 中等查看答案及解析
-
下图所述物质的用途中,主要利用其化学性质的是( )
A.
用金属制作奥运奖牌
B.
用钢材制造体育场“鸟巢”
C.
用羊绒作“福娃”的外层材料
D.
用丙烷做“祥云”火炬的燃料难度: 中等查看答案及解析
-
某粒子的结构示意图为
,下列说法中不正确的是( )
A.该元素原子的原子核外有2个电子层
B.该元素是一种金属元素
C.该粒子是阳离子
D.该粒子具有稳定结构难度: 中等查看答案及解析
-
2005年诺贝尔化学奖授予了三位科学家,以表彰他们在烯烃反应领域研究方面所取得的成就.下面是他们研究烯烃反应的示意图:该反应属于四种反应类型中的( )

A.化合反应
B.分解反应
C.置换反应
D.复分解反应难度: 中等查看答案及解析
-
下列实验操作正确的是( )
A.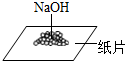 称量固体
称量固体
B.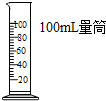
量取9.5mL液体
C.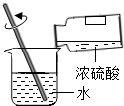 稀释浓硫酸
稀释浓硫酸
D.
滴加液体难度: 中等查看答案及解析
-
向下表的甲溶液中逐滴加入相应的乙溶液至过量,反应过程中溶质的pH变化与加入乙的体积关系,能用右下图曲线表示的是( )
序号 甲 乙 ① KOH溶液 HCl溶液 ② NaCl溶液 H2SO4溶液 ③ H2O HCl溶液 ④ NaOH和Na2SO4的混合液 H2SO4溶液 ⑤ Ba(OH)2溶液 NaCl溶液
A.①③
B.①④
C.①③④
D.①③④⑤难度: 中等查看答案及解析
-
下列图象中有关量的变化趋势与对应叙述关系正确的是 ( )
A.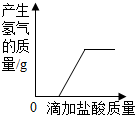 向一定质量表面生锈的铁片中滴加盐酸至过量
向一定质量表面生锈的铁片中滴加盐酸至过量
B.向一定质量的稀硫酸中滴加水
C.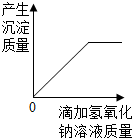 向氯化铁和盐酸的混合溶液中滴加氢氧化钠溶液至过量
向氯化铁和盐酸的混合溶液中滴加氢氧化钠溶液至过量
D.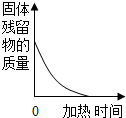 高温煅烧一定质量的石灰石
高温煅烧一定质量的石灰石 难度: 中等查看答案及解析
-
下列各组物质间通过一步反应就能实现如图转化,则甲、乙、丙可能是( )
A.NaOH NaCl NaNO3
B.CO2 C6H12O6 H2O
C.CaO Ca(OH)2 CaCO3
D.H2O2 H2O O2难度: 中等查看答案及解析