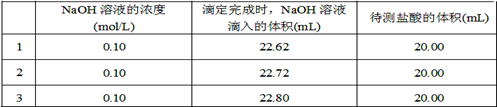
-
下列事实不属于盐类水解应用的是( )
A.明矾、氯化铁晶体常用于净水 B.实验室制氢气时加CuSO4可加快反应速率
C.实验室配制FeCl3溶液时加入少量稀盐酸 D.实验室通常使用热的纯碱溶液去除油污
难度: 简单查看答案及解析
-
下列化学用语表示正确的是
A.铁原子的电子排布式:[Ar]3d64s2 B.核内有8个中子的碳原子:
C.氢氧化钠的电子式:
D.F的原子结构示意图:
难度: 简单查看答案及解析
-
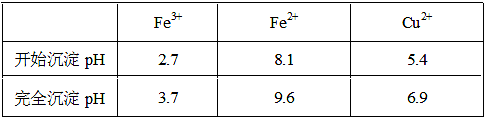
室温下,下列各组离子在指定溶液中一定能大量共存的是
A.pH=1的溶液中:Fe3+、NO3-、Cl-、Na+
B.由水电离的c(H+)=10-12mol·L-1的溶液中:Cl-、CO32-、K+、SO32-
C.c(OH-)/c(H+)=1012的溶液中:SO32-、NH4+、NO3-、K+
D.能使甲基橙呈红色的溶液中:Na+、AlO2-、NO3-、HCO3-
难度: 简单查看答案及解析
-
对H2O的电离平衡不产生影响的粒子是
A.
B.
C.26M3+ D.
难度: 简单查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,11.2LCCl4中含有的分子数目为0.5NA
B.常温下,1L0.1mol/LCH3COOH溶液中含有的H+数目为0.1NA
C.25℃,PH=13的NaOH溶液中含有OH-的数目为0.1NA
D.1L 1mol/L的NH4Cl溶液中,所含NH4+的数目小于NA
难度: 简单查看答案及解析
-
在蒸发皿中加热蒸干并灼烧(低于400℃)下列物质的溶液,可以得到该物质固体的是
A.氯化铝 B.碳酸氢镁 C.碳酸钠 D.高锰酸钾
难度: 简单查看答案及解析
-
下列比较正确的是
A.电负性:K原子>Na原子 B.离子半径:r(Al3+)>r(O2-)
C.能量:E(4s)>E(3d) D.第一电离能:I1(P)>I1(S)
难度: 简单查看答案及解析
-
下列水解的离子方程式正确的是
A.NH4++H2O
NH3·H2O+H+ B.Br-+H2O
HBr+OH-
C.CO32-+2H2O
H2CO3+2OH- D.Fe3++3H2O
Fe(OH)3↓+3H+
难度: 简单查看答案及解析
-
对于相同体积的K2CO3溶液(浓度为c1)和(NH4)2CO3溶液(浓度为c2),若其中
的物质的量浓度相同,则c1和c2的关系是
A.c1=2c2 B.c1>c2 C.c1=c2 D.c1<c2
难度: 简单查看答案及解析
-
取浓度相同的NaOH和HCl溶液,以3∶2体积比相混合,所得溶液的pH等于12,则原溶液的浓度为
A.0.01 mol/L B.0.017 mol/L C.0.05 mol/L D.0.50 mol/L
难度: 简单查看答案及解析
-
在d轨道中电子排布为
,而不排布成
,其最直接的根据是
A.能量最低原理 B.泡利不相容原理 C.原子轨道能级图 D.洪特规则
难度: 简单查看答案及解析
-
下列有关说法正确的是
A.25℃时,pH=5盐酸和pH=9的氨水,两溶液中水的电离程度不同
B.25℃时,Ksp(A)> Ksp(B),说明化合物A的溶解度比化合物B的大
C.常温下pH=4的盐酸中:c(H+)=c(OH-)+c(Cl-)
D.在NH4Cl溶液中加入适量硫酸,可使c(NH4+):c(Cl-)接近1:1
难度: 简单查看答案及解析
-
X、Y、Z是3种短周期元素,其中X、Y位于同一族,Y、Z处于同一周期。X原子的最外层电子数是其电子层数的3倍。Z原子的核外电子数比Y原子少1。下列说法正确的是( )
A.元素非金属性由弱到强的顺序为Z<Y<X
B.Y元素最高价氧化物对应水化物的化学式可表示为H3YO4
C.3种元素的气态氢化物中,Z的气态氢化物最稳定
D.原子半径由大到小的顺序为:Z>Y>X
难度: 简单查看答案及解析
-
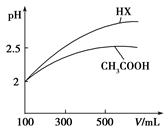
一定温度下,将一定质量的冰醋酸加水稀释,溶液的导电能力变化如图所示,下列说法中,正确的是

A.a、b、c三点溶液的pH:c<a<b
B.a、b、c三点醋酸的电离程度:c<a<b
C.若用湿润的pH试纸测量a处溶液的pH,测量结果偏小
D.a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:c<a<b
难度: 简单查看答案及解析
-
下列说法正确的是
A.常温下醋酸分子不可能存在于pH>7的碱性溶液中
B.常温下向氯化铵溶液中加入少量氨水使溶液的pH=7,则混合溶液中c(Cl-)>c(NH4+)
C.0.1 mol·L-1的氯化铵溶液与0.05 mol·L-1的氢氧化钠溶液等体积混合,溶液中离子浓度c(Cl-)>c(NH4+)>c(Na+)>c(OH-)
D.0.1 mol·L-1硫化钠溶液中离子浓度关系c(OH-)=c(H+)+c(HS-)+2c(H2S)
难度: 简单查看答案及解析