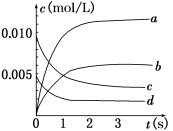
-
水是生命之源,下列有关各种“水”的说法中正确的是( )
A.双氧水被称为绿色氧化剂,是因为其还原产物为O2,对环境没有污染
B.王水是浓盐酸和浓硝酸按体积比1∶3配成的混合物,可以溶解Au、Pt
C.新制备的氯水中存在三种分子、四种离子
D.氨水能导电,说明氨气是电解质
难度: 中等查看答案及解析
-
少量铁粉与100 mL 0.01 mol/L的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的( )
①加H2O ②加NaOH固体③滴入几滴浓盐酸 ④加CH3COONa固体 ⑤加NaCl溶液 ⑥滴入几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发) ⑧改用10 mL 0.1 mol/L盐酸
A.①⑥⑦ B.③⑦⑧ C.③⑤⑧ D.⑤⑦⑧
难度: 中等查看答案及解析
-
“类推”是一种在化学学习中常用的方法,下列类推结论中正确的是( )
A.Al在氧气中生成Al2O3,Fe在氧气中也生成Fe2O3
B.工业上用电解熔融的氯化镁制备镁单质,工业上也可用电解熔融的氯化铝制备铝单质
C.BaCl2溶液中通入SO2无沉淀产生,则Ba(NO3)2溶液中通入SO2也无沉淀产生
D.第VA族氢化物的熔沸点顺序是NH3> AsH3> PH3 ;则第 VIA族氢化物的熔沸点顺序也是H2O>H2Se> H2S
难度: 中等查看答案及解析
-
下列有关实验操作及其结论正确的是( )
A.加入过量氨水,有白色沉淀生成,则原溶液中一定有Al3+
B.加入NaOH溶液然后加热,产生能使湿润的红色石蕊试纸变蓝的气体,则原溶液中一定有NH4+
C.加入用硝酸酸化的BaCl2溶液后有白色沉淀生成,则该无色溶液中一定含有Ag+
D.加入盐酸酸化的BaCl2溶液,有白色沉淀生成,则原溶液中一定有SO42-
难度: 中等查看答案及解析
-
NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
A.1mol NaBH4与足量水反应(NaBH4+H2O→NaBO2+H2↑,未配平)时转移的电子数为8NA
B.30g SiO2所含分子数为0.5NA
C.常温常压下,1mol NaHCO3与足量稀硫酸反应,生成气体的体积大于22.4L
D.0.06mol Na投入100mL 0.5mol/L 盐酸溶液中,产生气体的质量为0.05 g
难度: 困难查看答案及解析
-
已知二氯化二硫(S2Cl2)的结构式为Cl—S—S—Cl,它易与水发生反应2S2Cl2+2H2O=4HCl+SO2↑+3S↓。对该反应的说法正确的是( )
A.S2Cl2既作氧化剂又作还原剂
B.氧化产物与还原产物物质的量之比为3∶1
C.每生成1 mol SO2转移4 mol电子
D.H2O作还原剂
难度: 困难查看答案及解析
-
已知短周期元素甲、乙、丙、丁、戊的原子序数依次增大,其氢化物中甲、乙、丙、丁、戊的化合价如下,下列说法正确的是( )
元素
甲
乙
丙
丁
戊
化合价
﹣4
+1
﹣4
﹣2
﹣1
A.乙的常见氧化物只有一种 B.气态氢化物稳定性:丙>丁
C.原子半径大小:戊<丙 D.丙的氧化物能与戊的氢化物的水溶液反应
难度: 中等查看答案及解析
-
下列对各组离子或物质是否能够大量共存解释正确的是( )
A
溶液中:Al3+、Na+、SO42-、HCO3-
可以共存
不能发生反应
B
常温下,c(OH-)=1.0×10-13 mol/L溶液中,Fe2+、NO3-、SO42-、Na+
不能共存
发生反应:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
C
溶液中:K+、Cu2+、Cl-、NH3·H2O
不能共存
发生反应:Cu2++2OH-=Cu(OH)2↓
D
Ca2+、NH4+、CO32-、Cl-
可以共存
不能发生反应
难度: 困难查看答案及解析
-
恒温、恒容的条件下对于N2(g)+3H2(g)
2NH3(g) ΔH<0的反应,达到化学平衡状态的标志为( )
A.混合气体的密度不变
B.断开一个N≡N的同时有6个N-H键生成
C.N2、H2、NH3分子数之比为1∶3∶2的状态
D.混合气体的平均相对分子质量不变
难度: 中等查看答案及解析
-
Li﹣Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为:2Li++FeS+2e﹣=Li2S+Fe。有关该电池的下列说法中,正确的是( )
A.Li﹣Al在电池中作为负极材料,该材料中Li的化合价为+1价
B.负极的电极反应式为Al﹣3e﹣=Al3+
C.该电池的电池反应式为:2Li+FeS=Li2S+Fe
D.充电时,阴极发生的电极反应式为:Li2S+Fe﹣2e﹣=2Li++FeS
难度: 困难查看答案及解析
-
以酸性氢氧燃料电池为电源进行电解的实验装置如图所示。下列说法正确的是( )

A.燃料电池工作时,正极反应为O2+2H2O+4e-===4OH-
B.a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出
C.a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出
D.a、b两极若是石墨,相同条件下a极产生的气体与电池中消耗的H2体积相等
难度: 困难查看答案及解析
-
某兴趣小组同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,盐桥中装有饱和溶液。下列说法正确的是( )
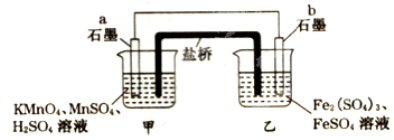
A.b电极上发生还原反应
B.外电路电子的流向是从a到b
C.电池工作时,盐桥中的SO42-移向甲烧杯
D.a电极上发生的反应为:MnO4-+8H++5e-=Mn2++4H2O
难度: 困难查看答案及解析
-
已知:H2O(g)===H2O(l) ΔH1=Q1kJ·mol-1;
C2H5OH(g)===C2H5OH(l) ΔH2=Q2kJ·mol-1;
C2H5OH(g)+3O2(g)===2CO2(g)+3H2O(g) ΔH=Q3kJ·mol-1。
若使用23g酒精液体完全燃烧,最后恢复到室温,则放出的热量为( )
A.Q1+Q2+Q3
B.1.5Q1-0.5Q2+0.5Q3
C.0.5(Q1+Q2+Q3)
D.0.5Q1-0.5Q2+0.5Q3
难度: 困难查看答案及解析
-
下图所示为800 ℃ 时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )
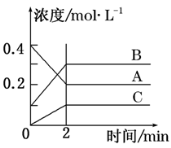
A.A是反应物
B.前2 min A的分解速率为0.1 mol·L-1·min-1
C.反应的方程式为:2A(g)
2B(g) +C(g)
D.达平衡后,若升高温度,平衡向正反应方向移动
难度: 中等查看答案及解析