-
硫酸酸化的草酸(H2C2O4,二元弱酸)溶液能将KMnO4溶液中的MnO转化为Mn2+,草酸被氧化为二氧化碳。某化学小组研究发现,少量MnSO4可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
(1)常温下,控制KMnO4溶液初始浓度相同,调节不同的初始pH和草酸溶液用量,做对比实验,完成以下实验设计表,填写空白。
| 实验 编号 | 温度 | 初始 pH | 0.1 mol/L草 酸溶液/mL | 0.01 mol/L KMnO4 溶液体积/mL | 蒸馏水 体积/mL | 待测数据(反应混合液褪色时间/s) |
| ① | 常温 | 1 | 20 | 50 | 30 | t1 |
| ② | 常温 | 2 | 20 | 50 | 30 | t2 |
| ③ | 常温 | 2 | 40 | V1= | V2= | t3 |
(2)该反应的化学方程式 。
(3)若t1<t2,则根据实验①和②得到的结论是 。
(4)某小组同学按①进行实验发现反应速率变化如下图,其中t1~t2时间内速率变快的主要原因可能是:①产物Mn2+是反应的催化剂、② 。

(5)化学小组用滴定法测定KMnO4溶液物质的量浓度:取a g草酸晶体(H2C2O4·2H2O,摩尔质量126 g/mol)溶于水配成250 mL溶液,取25.00 mL溶液置于锥形瓶中,加入适量稀H2SO4酸化,再用KMnO4溶液滴定至终点,重复滴定两次,平均消耗KMnO4溶液V mL。滴定到达终点的现象是: ;实验中装KMnO4溶液用到 滴定管(填酸式或碱式)。该KMnO4溶液的物质的量浓度为 mol/L。
-
(17分)有硫酸酸化的草酸(H2C2O4,二元弱酸)溶液能将KMnO4溶液中的MnO4-转化为Mn2+。某化学小组研究发现,少量MnSO4可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
(1)常温下,控制KMnO4溶液初始浓度相同,调节不同的初始pH和草酸溶液用量,做对比实验,完成以下实验设计表。
| 实验 编号 | 温度 | 初始pH | 0.1 mol/L草酸溶液/mL | 0.01mol/LKMnO4溶液体积/mL | 蒸馏水 体积/mL | 待测数据(反应混合液褪色时间/s) |
| ① | 常温 | 1 | 20 | 50 | 30 | t1 |
| ② | 常温 | 2 | 20 | 50 | 30 | t2 |
| ③ | 常温 | 2 | 40 | __________ | ______ | t3 |
(2)该反应的离子方程式_______________________________。
(3)若t1<t2,则根据实验①和②得到的结论是_______________________________。
(4)请你设计实验验证MnSO4对该反应起催化作用,完成下表中内容。
| 实验方案(不要求写出具体操作过程) | 预期实验结果和结论 |
| _________________________ | _________________________ |
(5)化学小组滴定法测定KMnO4溶液物质的量浓度:取ag草酸晶体(H2C2O4•2H2O,摩尔质量126g/mol)溶于水配成250mL溶液,取25. 00mL溶液置于锥形瓶中,加入适量稀H2SO4酸化,再用KMnO4溶液滴定至终点,重复滴定两次,平均消耗KMnO4溶液VmL。滴定到达终点的现象是: _______________________;实验中所需的定量仪器有________________(填仪器名称)。该KMnO4溶液的物质的量浓度为_______mol/L。
-
用酸性KMnO4溶液与H2C2O4溶液反应来探究影响化学反应速率的因素:
Ⅰ.实验前先用酸性KMnO4标准溶液滴定未知浓度的草酸
反应原理: MnO
MnO +
+ H2C2O4+
H2C2O4+ ―→
―→ Mn2++
Mn2++ CO2↑+
CO2↑+ H2O
H2O
(1)配平上述离子方程式。______
(2)滴定时KMnO4溶液应盛装于__________(填“酸式”或“碱式”)滴定管中。
Ⅱ.探究影响化学反应速率的因素
| 实验 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度 |
| 浓度/mol·L-1 | 体积/mL | 浓度/mol·L-1 | 体积/mL |
| ① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
| ② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| ③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
| | | | | |
(1)探究温度对化学反应速率影响的实验编号是________(填编号,下同)。
(2)探究反应物浓度对化学反应速率影响的实验编号是________。
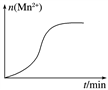
Ⅲ.测得某次实验(恒温)时溶液中Mn2+物质的量与时间关系如图所示,请解释“n(Mn2+)在反应起始时变化不大,一段时间后快速增大”的原因:________________________。
-
草酸溶液能使酸性KMnO4溶液褪色,其离子方程式为
MnO4-+H2C2O4+H+→CO2↑+Mn2++ (未配平)。关于此反应的叙述正确的是( )
(未配平)。关于此反应的叙述正确的是( )
A.该反应的氧化剂是H2C2O4 B.1molMnO4-在反应中失去5mol电子
C.该反应右框内的产物是OH- D.配平该反应后,H+的计量数是6
-
草酸溶液能使酸性KMnO4溶液褪色,其离子方程式为:MnO4-+H2C2O4+H+→CO2↑+Mn2++__(未配平)。关于此反应的叙述正确的是
A.该反应的还原产物是CO2 B.该反应右框内的产物是OH-
C.配平该反应后,H+计量数是6 D.1molMnO4-在反应中失去5mol电子
-
草酸溶液能使酸性KMnO4溶液褪色,其离子方程式为:MnO4-+H2C2O4+H+→CO2↑+Mn2++__(未配平).关于此反应的叙述正确的是( )
A.该反应的还原产物是CO2
B.该反应右框内的产物是OH-
C.配平该反应后,H+计量数是6
D.1molMnO4-在反应中失去5mol电子
-
小明做实验时不小心沾了一些KMnO4,皮肤上的黑斑很久才能消除,如果用草酸的稀溶液洗涤马上可以复原,其离子方程式为:MnO4-+H2C2O4+H+→CO2↑+Mn2++□(未配平)。关于此反应的叙述正确的是( )
A.该反应的氧化剂是H2C2O4 B.1molMnO4-在反应中失去5mol电子
C.该反应右框内的产物是OH- D.配平该反应后,H+的计量数是6
-
小明做实验时不小心沾了一些KMnO4,皮肤上的黑斑很久才能消除,如果用草酸的稀溶液洗涤马上可以复原,其离子方程式为:MnO4-+H2C2O4+H+→CO2↑+Mn2++□(未配平).关于此反应的叙述正确的是( )
A.该反应的氧化剂是H2C2O4
B.1molMnO4-在反应中失去5mol电子
C.该反应右框内的产物是OH-
D.配平该反应后,H+的计量数是6
-
小明做实验时不小心沾了一些KMnO4,皮肤上的黑斑很久才能消除,如果用草酸的稀溶液洗涤马上可以复原,其离子方程式为:MnO4-+H2C2O4+H+→CO2↑+Mn2++□(未配平)。关于此反应的叙述正确的是( )
A. 该反应的氧化剂是H2C2O4 B. 1molMnO4-在反应中失去5mol电子
C. 该反应右框内的产物是OH- D. 配平该反应后,H+的计量数是6
-
小明做实验时不小心沾了一些KMnO4,皮肤上的黑斑很久才能消、除,如果用草酸的稀溶液洗涤马上可以复原,其离子方程式为:MnO4-+H2C2O4+H+→CO2↑+Mn2++□(未配平)。关于此反应的叙述正确的是
A.该反应的氧化剂是H2C2O4 B.1molMnO4-在反应中失去5mol电子
C.该反应右框内的产物是OH- D.配平该反应后,H+的计量数是6

