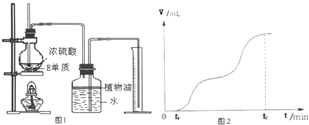
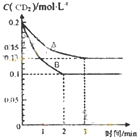
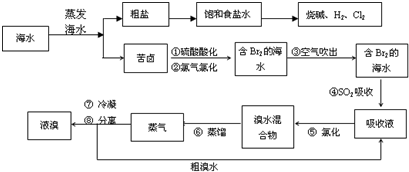
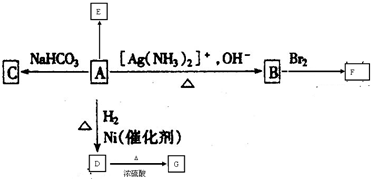
-
某无色溶液中可能含有 ①Na+、②Ba2+、③Cl-、④Br-、⑤SO42-、⑥SO32-离子中的若干种,依顺序进行下列实验,且每步所加试剂均过量,观察到的现象如下:
下列结论正确的是( )步骤 操作 现象 1 用pH试纸检验 溶液的pH大于7 2 向溶液中滴加氯水,再加入CCl4振荡,静置 CCl4层呈橙色 3 向所得水溶液中加入Ba(NO3)2溶液和稀HNO3 有白色沉淀产生 4 过滤,向滤液中加入AgNO3溶液 有白色沉淀产生
A.肯定含有的离子是①④⑥
B.不能确定的离子是①
C.肯定没有的离子是②⑤
D.不能确定的离子是③⑤难度: 中等查看答案及解析
-
锑在自然界一般以硫化物的形式存在,我国锑的蕴藏量占世界第一.从硫化物中提取单质锑一般是先在高温下将硫化物转化为氧化物,再用碳还原:①2Sb2S3+3O2+6Fe=Sb4O6+6FeS ②Sb4O6+6C=4Sb+6CO 关于反应①、②的说法正确的是( )
A.反应①②中的氧化剂分别是Sb2S3、Sb4O6
B.反应①中每生成3molFeS时,共转移6mol电子
C.反应②说明高温下Sb的还原性比C强
D.每生成4molSb时,反应①与反应②中还原剂的物质的量之比为4:3难度: 中等查看答案及解析
-
2008年北京奥运会主体育场“鸟巢”,被《泰晤士报》评为全球“最强悍”工程.“鸟巢”运用了高强度、高性能的钒氮合金高新钢和884块ETFE膜,并采用新一代的氮化镓铟高亮度LED材料.有关说法正确的是( )
A.合金的熔点通常比组分金属高,硬度比组分金属小
B.已知Ga处于ⅢA族,可推知氮化镓化学式Ga3N2
C.用金属铝与V2O5冶炼钒,铝作还原剂
D.ETFE膜材料-[CH2-CH2-CF2-CF2]n-是纯净物难度: 中等查看答案及解析
-
以NA表示阿佛加德罗常数,下列说法正确的是( )
A.T℃时,1LpH=6的纯水中,含H+数为10-6NA个
B.15.6gNa2O2与过量的CO2反应时,转移的电子数为0.4NA
C.1molSiO2中含2molSi-O单键
D.如果5.6LN2中含有n个氮分子,则阿伏加德罗常数一定约为4n难度: 中等查看答案及解析
-
以下离子方程式正确的是( )
A.氧化铁溶于氢碘酸:Fe2O3+6H+=2Fe3++3H2O
B.硫化钠溶液呈碱性的原因:S2-+2H2O=H2S↑+2OH-
C.等物质的量的KHCO3和Ba(OH)2的溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O
D.将少量的SO2气体通入足量的NaClO溶液中:2ClO-+SO2+H2O=2HClO+SO32-难度: 中等查看答案及解析
-
用铅蓄电池电解苦卤水(含C1-、Br-、Na+、Mg2+)的装置如图所示 (a、b为石墨电极).下列说法中正确的是( )
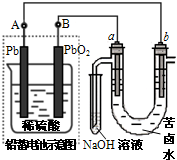
A.铅蓄电池放电时,溶液的pH变小
B.铅蓄电池负极的反应式为:Pb-2e-+SO42-=PbSO4
C.铅蓄电池充电时,B极应与外电源负极相连
D.电解苦卤水时,电极首先放电的是H+难度: 中等查看答案及解析
-
右图是一水溶液在pH从0至14的范围内H2CO3、HCO3-、CO32-三种成分平衡时组成分数,下列叙述不正确的是( )
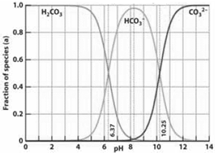
A.人体血液的pH约为7.4,则CO2在血液中多以HCO3-形式存在
B.在pH为10.25时,溶液中c(HCO3-)=c(CO32-)
C.若用CO2和NaOH反应制取Na2CO3,溶液的pH必须控制在12以上
D.此图是1.0mol/L碳酸钠溶液滴定1.0mol/LHCl溶液的滴定曲线难度: 中等查看答案及解析