-
“神州七号”三兄弟——LiH、LiD、LiT。其中Li的质量数为7,对这三种物质的下列说法正确的是 ( )
A.质子数之比为1:2:3 B.中子数之比为1:1:1
C.摩尔质量之比为8:9:10 D.化学性质不相同
难度: 极难查看答案及解析
-
下列说法正确的是 ( )
A.IA族元素的金属性一定比IIA族元素的金属性强
B.ⅥA族元素中氢化物最稳定的其沸点一定最高
C.非金属元素只能形成共价化合物
D.短周期中,同周期元素的离子半径从左到右逐渐减小
难度: 极难查看答案及解析
-
下列现象或事实可用同一化学原理加以说明的是 ( )
A.氯化铵和氯化钠的混合物、碘和氯化钠的混合物都可以用加热法进行提纯
B.氯水和二氧化硫气体均能使品红溶液褪色
C.硫酸亚铁溶液和氢氧化钠溶液在空气中久置后均会变质
D.铁片和铝片置于冷的浓硫酸中均无明显现象
难度: 极难查看答案及解析
-
下列褪色过程不是因为氧化还原反应而褪色的是 ( )
A.SO2气体通入溴水使溴水褪色
B.氯水使滴有酚酞的NaOH溶液褪色,加入NaOH后不变红
C.将苯滴入溴水中振荡,溴水层褪色
D.将含有碘单质的淀粉溶液,加入NaOH溶液后蓝色褪去
难度: 极难查看答案及解析
-
下列叙述中正确的是 ( )
A.稀有气体的晶体中不存在分子间作用力
B.C—12的原子组成符号为
,二氧化碳分子的结构式为O=C=O
C.Na2O和Na2O2所含化学键类型完全相同
D.Br2蒸气被木炭吸附时共价键被破坏
难度: 极难查看答案及解析
-
下列除去杂质的实验方法不正确的是 ( )
A.除去CO2中少量HCl气体:通过饱和NaHCO3溶液后再干燥气体
B.除去Na2CO3固体中少量NaHCO3:置于坩埚中加热
C.除去Cl2中的HCl气体:通过NaOH溶液
D.除去FeCl3酸性溶液中少量的FeCl2:通入稍过量的Cl2
难度: 极难查看答案及解析
-
下列叙述正确的是 ( )
A.CH4O和C2H6O一定互为同系物
B.16g CH4与18 g NH
所含质子数相等
C.32S与33S的核外电子数相等,是同一种核素
D.质量相等、体积不等的N2和C2H4的分子数相等
难度: 极难查看答案及解析
-
下列大小顺序排列完全正确的组合是 ( )
①气态氢化物的稳定性:HF>NH3>PH3
②熔点:Na>C3H8>CH3OH
③离子半径:K+>Ca2+>S2—
④相同温度、相同浓度的溶液中水的电离程度:NH4Cl>CH3COOH>HCl
A.①④ B.①② C.②③ D.③④
难度: 极难查看答案及解析
-
下列离子方程式中,不正确的是 ( )
A.用碳棒作电极电解硫酸铜溶液: 2Cu2+ + 2H2O = 2Cu + O2↑+ 4H+
B.在硫酸氢钾溶液中加入氢氧化钡溶液至中性 :
Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
C.向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全:
2Al3++ 3SO42-+ 3Ba2+ + 6OH-=2Al(OH)3↓+ 3BaSO4↓
D.硫酸亚铁的酸性溶液中加入H2O2溶液:
2Fe2++H2O2+2H+=2 Fe3++2H2O
难度: 极难查看答案及解析
-
在配制一定物质的量浓度的盐酸时,下列操作可使所配溶液浓度偏高的是 ( )
A.用量筒量取浓盐酸时俯视读数
B.溶解搅拌时有液体飞溅
C.定容时俯视容量瓶瓶颈刻度线
D.摇匀后见液面下降,再加水至刻度线
难度: 极难查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列叙述正确的是 ( )
A.0.1molCnH2n+2中含有的C-C键数为0.1NA
B.6.9g钠与足量的CO2和H2O(g)混合气体充分反应,转移的电子数一定为0.3NA
C.0.1mol/L的氯化铝溶液中含有的氯离子数为0.3NA
D.标准状况下,2.24L氯仿中含有C-Cl键数为0.3NA
难度: 极难查看答案及解析
-
从下列事实所列出的相应结论正确的是 ( )
实 验 事 实
结 论
A
Cl2的水溶液可以导电
Cl2是电解质
B
SO2通入硝酸钡溶液出现白色沉淀
BaSO3不溶于强酸
C
NaHCO3溶液与NaAlO2溶液混合产生白色沉淀
酸性:HCO3->Al(OH)3
D
SO2通入KMnO4溶液,溶液褪色
SO2具有漂白性
难度: 极难查看答案及解析
-
氮化钠和氢化钙都是离子化合物,与水反应的化学方程式(未配平)如下:
Na3N+H2O →NaOH +NH3 ,CaH2+H2O →Ca(OH)2 +H2.有关它们的叙述:
①离子半径:Na+>N3->H+ ;②与水反应都是氧化还原反应;③与水反应后的溶液都显碱性;④与盐酸反应都只生成一种盐;⑤两种化合物中的阴阳离子均具有相同的电子层结构。其中正确的是 ( )
A.②③④⑤ B.①③⑤ C.②④ D.③
难度: 极难查看答案及解析
-
a g下列物质在氧气中充分燃烧后的气体(1.01×105 Pa,120℃),通过足量的过氧化钠充分反应后,过氧化钠增重b g,符合b>a 的选项有 ( )
A.HCHO B.CH3COOCH2CH3
C.HOOCCOOH D.HCOOH
难度: 极难查看答案及解析
-
下列对化学知识的总结,你认为合理的组合是 ( )
①能与酸反应的氧化物,一定是碱性氧化物
②原子晶体、离子晶体、金属晶体、分子晶体中都一定存在化学键
③原子晶体熔点不一定比金属晶体高,分子晶体熔点不一定比金属晶体低
④在熔化状态或水溶液中能导电的物质称为电解质
⑤NF3的沸点比NH3的沸点低是因为N-F键比N-H键的键能大
⑥过氧化氢和液氮的分子中都有非极性共价键
A.只有③④ B.只有③⑥
C.只有⑤⑥ D.只有①②⑥
难度: 极难查看答案及解析
-
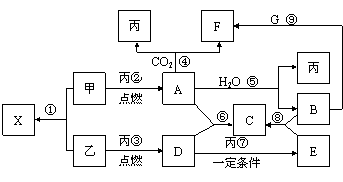
甲、乙为短周期同一主族元素组成的单质,丙、丁为含氧化合物,它们存在如下转化关系:满足条件的甲和乙分别为 ( )
A.铝和铁 B.氯气和溴
C.铝和氢气 D.钠和氢气
难度: 极难查看答案及解析
-
常温下,下列各组离子在给定条件下一定能大量共存的是 ( )
A.在pH=0的溶液中:I-、Ca2+、NO3-、NH4+
B.存在大量Fe2+的溶液:SCN-、Na+、NO3-、SO42-
C.在由水电离出的c(OH-)=10-13mol·L-1的溶液中:ClO-、Na+、SO32-、Cl-
D.在c(OH-)=1.0ⅹ10-13 mol·L-1的溶液中:Na+、S2-、AlO2-、SO32-
难度: 极难查看答案及解析
-
图为短周期的一部分,推断关于Y、Z、M的说法正确的是 ( )
A.非金属性:Y>Z>M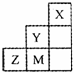
B.原子半径:M>Z>Y
C.气态氢化物的稳定性:Y<M<Z
D.ZM2分子中各原子的最外层电子均满足8e—稳定结构
难度: 极难查看答案及解析
-
将磁性氧化铁放入稀HNO3中可发生如下反应:3Fe3O4+ 28HNO3=9Fe (NO3)x+ NO↑+14H2O 。下列判断合理的是 ( )
A.Fe (NO3)x中的x为2
B.反应中每生成0.2 mol 还原产物,就有0.6 mol 电子转移
C.稀HNO3 在反应中只作氧化剂
D.磁性氧化铁中的铁元素全部被氧化
难度: 极难查看答案及解析
-
下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他反应产物及反应所需条件均已略去),当X是强碱时,过量的B跟Cl2反应除生成C外,另一产物是盐酸盐。
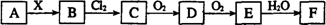
下列说法中不正确的是 ( )
A.当X是强酸时,A、B、C、D、E、F中均含同一种元素,F可能是H2SO4
B.当X是强碱时,A、B、C、D、E、F中均含同一种元素,F是HNO3
C.B和Cl2的反应是氧化还原反应
D.当X是强酸时,C在常温下是气态单质
难度: 极难查看答案及解析
-
将Mg、Cu组成的混合物26.4g,投入到适量的稀硝酸中,固体完全溶解,收集到标准状况下的NO气体8.96L,向反应后的溶液中加入过量的5mol/L的NaOH溶液300mL,金属离子完全沉淀。则形成沉淀的质量是: ( )
A.
B.
C.
D.
难度: 极难查看答案及解析
-
下列叙述正确的是 ( )
A.0.1mol/L NaOH溶液和0.1mol/L NH4Cl溶液等体积混合后
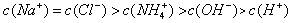
B.NaHCO3溶液中:
C.只含有
、
、
、
的溶液中一定有:
D.25℃时,pH=2的醋酸溶液与pH=12的
溶液等体积混合:
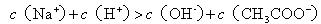
难度: 极难查看答案及解析
-
下列有关热化学方程式的叙述正确的是 ( )
A.已知2H2(g)+O2(g)= 2H2O(g);△H=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ/mol
B.已知C(石墨,s)= C(金刚石,s);△H>0,则金刚石比石墨稳定
C.含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则该反应中和热的热化学方程式为:NaOH+HCl=NaCl+H2O;△H=-57.4 kJ/mol
D.已知2C(s)+2O2(g)=2CO2(g);△H1,2C(s)+O2(g)=2CO(g) ;△H2。则△H1<△H2
难度: 极难查看答案及解析
-
几种短周期元素的原子半径及某些化合价见下表,下列说法正确的是 ( )
元素代号
A
B
D
E
G
H
I
J
化合价
–1
–2
+4、–4
+7、–1
+5、–3
+3
+2
+1
原子半径/nm
0.071
0.074
0.077
0.099
0.110
0.143
0.160
0.186
A.A的单质能将E单质从HE3的溶液中置换出来
B.A、H、J的离子半径由大到小顺序是A>J>H
C.G元素的单质不存在同素异形体
D.I在DB2中燃烧生成两种化合物
难度: 极难查看答案及解析
-
用石墨电极电解含有一定量重水(D2O)的水(H2O),下列说法正确的是 ( )
A.相同状况下两电极上产生的气体体积之比为2∶1
B.两电极上产生的气体质量之比为8∶1
C.相同状况下两电极上产生的气体体积之比为4∶1
D.若两电极上产生的气体质量比为16∶3,则D2O与H2O的物质的量之比为2∶1
难度: 极难查看答案及解析