-
下列说法正确的是
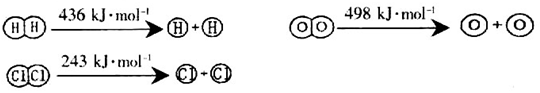
A.16O和18O互为同位素
B.漂白粉、液氯、干冰均为混合物
C.稀硫酸、氨水均为电解质
D.溶于水能电离出H+的物质一定是酸
难度: 简单查看答案及解析
-
下列有关金属的说法中不正确的是
A.纯铁比生铁抗腐蚀性强
B.青铜、不锈钢、硬铝都是合金
C.铝在空气中耐腐蚀,所以铝是不活泼金属
D.人体缺钙会引起骨质疏松症,缺铁会引起贫血
难度: 简单查看答案及解析
-
依据物质的相关数据,可以推断物质的结构和性质。下列利用物质的相关数据作出的相应推断不合理的是
A.依据元素的原子序数,推断该元素原子的核外电子数
B.依据原子最外层电子数的多少,推断元素金属性、非金属性的强弱
C.依据气体的摩尔质量,推断相同状态下不同气体密度的大小
D.依据液体物质的沸点,推断将两种互溶液态混合物用蒸馏法分离的可行性
难度: 中等查看答案及解析
-
下列有关化学用语的表述正确的是
A.质子数与中子数相等的氢原子符号:
B.蔗糖和麦芽糖的分子式:C12H22O11
C.乙烯的结构简式:CH2CH2
D. 35Cl-、37Cl-的结构示意图:
难度: 中等查看答案及解析
-
下列说法中正确的是
A.SiO2既能溶于NaOH溶液又能溶于氢氟酸,说明SiO2是两性氧化物
B.将Cu片置于浓H2SO4中,无明显现象,说明Cu在冷的浓硫酸中被钝化
C.自来水厂可用明矾对水进行杀菌消毒
D.常温下氨能与氯气反应生成氯化氢和氮气,因此可用浓氨水检查氯气管道中某处是否泄漏
难度: 中等查看答案及解析
-
下列说法正确的是
A.等物质的量的甲基(-CH3)与羟基(-OH)所含电子数相等
B.等物质的量浓度的NaOH溶液与氨水中的c(OH-)相等
C.含有相同氧原子数的SO2和CO的质量相等
D.25℃和101kpa,1 mol CO的体积小于22.4L
难度: 中等查看答案及解析
-
下列关于有机物的说法中,正确的一组是
①“乙醇汽油”是在汽油里加入适量乙醇而成的一种燃料,它是一种新型化合物
②汽油、柴油和植物油都是碳氢化合物,完全燃烧只生成CO2和H2O
③石油的分馏、裂化和煤的干馏都是化学变化
④除去乙酸乙酯中残留的乙酸,可加过量饱和碳酸钠溶液振荡后,静置分液
⑤将ag铜丝灼烧成黑色后趁热插入乙醇中,铜丝变红,再次称量质量等于ag
⑥除去CH4中的少量C2H4,可将混合气体通过盛有饱和溴水的洗气瓶
A.③⑤⑥ B.④⑤⑥ C.①②⑤ D.②④⑥
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A.Cu(OH)2中加入硫酸:OH-+H+=H2O
B.钠加入水中:Na+2H2O=Na++2OH-+H2↑
C.向Ca(HCO3)2溶液加入过量NaOH溶液:2Ca2++2HCO3-+2OH-=2H2O+CO32—+CaCO3↓
D.Al2(SO4)3溶液中加入过量Ba(OH)2溶液:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数。下列叙述不正确的是
A.标准状况下,22.4LO3含有分子的数目为NA
B.常温常压下,4.0gCH4中含有共价键的数目为NA
C.电解精炼铜时,当电路中转移NA个电子,阳极溶解32g铜
D.标准状况下,2.24LCl2与足量NaOH溶液反应,转移电子数目为0.1NA
难度: 中等查看答案及解析
-
下列物质间的转化在给定条件下能实现的是

A.②④ B.③④ C.①④ D.①②
难度: 中等查看答案及解析
-
将液体A滴入烧瓶与气体B充分反应,打开夹子,可发现试管内的水立刻沸腾了,则液体A和气体B的组合不可能是

A.水、氯化氢 B.硫酸、氨气
C.氢氧化钠溶液、二氧化硫 D.氢氧化钠溶液、一氧化碳
难度: 中等查看答案及解析
-
短周期A、B、C、D的原子序数依次增大。A原子的最外层电子数是内层电子数的2倍,元素B在同周期的主族元素中原子半径最大,元素C的合金是日常生活中常用的金属材料,D位于第VIA族。下列说法正确的是
A.原子半径:D>B>C>A
B.元素A、B的氧化物具有相同类型的化学键
C.B、C、D的最高价氧化物对应的水化物能相互反应
D.元素B和C的最高价氧化物对应水化物的碱性:C>B
难度: 中等查看答案及解析
-
下列有关说法中,正确的是
A.某饱和溶液变成不饱和溶液,溶质的质量分数一定减小
B.向FeSO4溶液中滴加NaOH溶液,先出现白色沉淀,最终沉淀转化成红褐色
C.将Fe(OH)3胶体和泥水分别进行过滤,发现均有固体物质不能通过滤纸
D.常温下,BaSO4在饱和Na2SO4溶液中的Ksp比在纯水中的Ksp小
难度: 中等查看答案及解析
-
下列各组离子在指定溶液中,一定有大量共存的是
A.pH=0的溶液中:Na+、[Al(OH)4]-、K+、NH4+
B.由水电离出的c(H+)=10-12mol/L的溶液中:C1-、HCO3-、NH4+、SO32-
C.加入铝能离出H2的溶液中:Mg2+、NH4+、C1-、SO42-
D.滴加石蕊试液显蓝色的溶液:K+、Ba2+、NO3-、OH-
难度: 中等查看答案及解析
-
对剧毒的氰化物可在碱性条件下用如下方法进行处理:2CN-+8OH-+5Cl2=2CO2+N2+10Cl-+4H2O。下列判断正确的是
A.当有0.2mol CO2生成时,溶液中阴离子的物质的量增加1mol
B.该反应中,每有2molCN-反应,转移电子为10mol
C.上述反应中的还原剂是OH-
D.还原性:C1->CN-
难度: 中等查看答案及解析
-
两体积的密闭容器中均充入1mol X和1mol Y,分别用于300℃和500℃开始发生反应:X(g)+Y(g)
3Z(g)。Z的含量(Z%)随时间t的变化如图所示。已知在
时刻改变了某一实验条件。下列判断正确的是

A.曲线a是500℃时的图像 B.正反应是吸热反应
C.
时刻可能是增大了压强 D.
时刻可能是降低了温度
难度: 中等查看答案及解析
-
20℃时,有体积相同的四种溶液:①pH=3的CH3COOH溶液 ②pH=3的盐酸 ③pH=11的氨水 ④pH=11的NaOH溶液。下列说法不正确的是
A.若将四种溶液稀释100倍,溶液pH的大小顺序:③>④>①>②
B.③和④分别用等浓度的硫酸溶液中和,消耗硫酸溶液的体积:③>④
C.①与②混合,所得混合溶液的pH=3
D.②和③混合后,溶液呈碱性
难度: 中等查看答案及解析
-
常温下有A、B、C、D四种无色溶液,它们分别是CH3COONa溶液、NH4C1溶液、盐酸和Na2SO4溶液中的一种。已知A、B溶液中水的电离程度相同,A、C溶液的pH相同。下列说法中不正确的是
A.D溶液的pH=7
B.四种溶液相比,C溶液中水的电离程度最大
C.A与C等体积混合,溶液中有c(Cl-)>c(NH4+)>c(H+)>c(OH-)
D.B与D等体积混合后,溶液中有c(OH-)=c(CH3COOH)+c(H+)
难度: 中等查看答案及解析