-
(10分)最近雾霾天气肆虐我国大部分地区,其中SO2是造成空气污染的主要原因,利用钠碱循环法可除去SO2。
(1)钠碱循环法中,吸收液为Na2SO3溶液,该反应的离子方程式是 。
(2)已知H2SO3的电离常数为K1=1.54×10-2,K2=1.024×10-7,H2CO3的电离常数为K1=4.30×10-7,K2=15.60×10-11,则下列微粒可以大量共存的是 (填序号)
A.CO32- 、HSO3- B.HSO3- 、HCO3- C.SO32- 、HCO3- D.HCO3-、H2SO3
(3)吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
①根据上表判断NaHSO3溶液显 性,试解释原因
②在NaHSO3溶液中离子浓度关系不正确的是
A.c(Na+)=2c(SO32-)+c(HSO3-)
B.c(H2SO3)+c(H+)= c(SO32-)+c(OH-)
C.c(Na+)> c(HSO3-)> c(H+)> c(SO32-)> c(OH-)
D.c(H+)+ c(Na+)=2c(SO32-)+c(HSO3-)+ c(OH-)
-
(8分)最近雾霾天气又开始肆虐我国大部分地区。其中SO2是造成空气污染的主要原因,利用钠碱循环法可除去SO2。
(1)钠碱循环法中,吸收液为Na2SO3溶液,该吸收反应的离子方程式是________
(2)已知H2SO3的电离常数为 K1=1.54×10-2 , K2=1.02×10-7, H2CO3的电离常数为 K1=4.30×10-7, K2= 5.60×10-11,则下列微粒可以共存的是_____________。
A.CO32- HSO3- B.HCO3- HSO3-
C.SO32- HCO3- D.H2SO3 HCO3-
(3)吸收液吸收SO2的过程中,pH随n(SO3²﹣):n(HSO3﹣)变化关系如下表:
| n(SO3²﹣):n(HSO3﹣) | 91 :9 | 1 :1 | 1 :91 |
| pH | 8.2 | 7.2 | 6.2 |
①上表判断NaHSO3溶液显 性,从原理的角度解释原因
②在NaHSO3溶液中离子浓度关系不正确的是(选填字母):
A.(Na+)= 2c(SO32-)+ c(HSO3-),
B.(Na+)> c(HSO3-)> c(H+)> c(SO32-)> c(OH-),
C.(H2SO3)+ c(H+)= c(SO32-)+ (OH-),
D.(Na+)+ c(H+)= 2 c(SO32-)+ c(HSO3-)+ c(OH-)
(4)当吸收液的pH降至约为6时,需送至电解槽再生 。再生示意图如下:

① 吸收液再生过程中的总反应方程式是 。
② 当电极上有1mol电子转移时阴极产物为 克.
-
最近雾霾天气肆虐我国大部分地区。其中SO2是造成空气的污染的主要原因,利用钠碱循环法可除去SO2。
(1)钠碱循环法中,吸收液为Na2SO3溶液,该反应的离子方程式是________。
(2)已知H2SO3的电离常数为K1=1.54×10-2,K2=1.024×10-7;H2CO3的电离常数为K1=4.30×10-7,K2=5.60×10-11,则下列微粒可以大量共存的是______(填序号)。
A.CO32- HSO3- B. HCO3- HSO3- C. SO32- HCO3- D. H2SO3 HCO3-
(3)吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
①根据上表判断NaHSO3溶液显_______性,试解释原因__________________________;
②在NaHSO3溶液中离子浓度关系不正确的是_______(填序号)。
A.c(Na+)=2c(SO32-)+c(HSO3-)
B.c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)
C.c(H2SO3)+ c(H+)=c(SO32-)+c(OH-)
D.c(Na+)+ c(H+)=2c(SO32-)+ c(HSO3-)+ c(OH-)
(4)当吸收液的pH降至约为6时,需送至电解槽处理,直至得到pH>8的吸收液再循环利用,电解示意图如下:

①写出阳极上发生的电极反应式____________;
②当电极上有1mol电子转移时阴极产物的质量为__________。
-
最近雾霾天气肆虐我国大部分地区。其中 是造成空气污染的主要原因,利用钠碱循环法可除去
是造成空气污染的主要原因,利用钠碱循环法可除去 。
。
 钠碱循环法中,吸收液为
钠碱循环法中,吸收液为 溶液中各离子浓度由大到小的顺序为_____________。
溶液中各离子浓度由大到小的顺序为_____________。
 溶液吸收
溶液吸收 反应的离子方程式是__________________________________。
反应的离子方程式是__________________________________。
 已知
已知 的电离常数为
的电离常数为 ,
, ;
; 的电离常数为
的电离常数为 ,
, ,则下列微粒可以大量共存的是______
,则下列微粒可以大量共存的是______ 填序号
填序号 。
。
A. 和
和
 和
和
 和
和
 和
和
 吸收液吸收
吸收液吸收 的过程中,水溶液中
的过程中,水溶液中 、
、 、
、 随pH的分布如图:
随pH的分布如图:
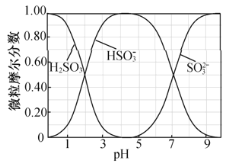
 吸收
吸收 制备
制备 溶液,实验中确定何时停止通
溶液,实验中确定何时停止通 的实验操作为_________________。
的实验操作为_________________。
 在
在 溶液中离子浓度关系不正确的是_______
溶液中离子浓度关系不正确的是_______ 填序号
填序号 。
。
A.

C.
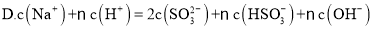
 亚硫酰氯
亚硫酰氯 又名氯化亚砜,是一种液态的非电解质,沸点为
又名氯化亚砜,是一种液态的非电解质,沸点为 。
。 中氯元素与硫元素直接以共价键相连,其中Cl呈
中氯元素与硫元素直接以共价键相连,其中Cl呈 价;
价; 遇水可生成
遇水可生成 。请回答下列问题:蒸干
。请回答下列问题:蒸干 溶液不能得到无水
溶液不能得到无水 ,若将
,若将  与
与 混合并加热,可制得无水
混合并加热,可制得无水 ,请用
,请用  与水反应的方程式和必要的文字描述解释原因________________________________________________________。
与水反应的方程式和必要的文字描述解释原因________________________________________________________。
-
SO2的含量是空气质量日报中一项重要检测指标,也是最近雾霾天气肆虐我国大部分地区的主要原因之一。加大SO2的处理力度,是治理环境污染的当务之急。
I.电化学法处理SO2。
硫酸工业尾气中的SO2经分离后,可用于制备硫酸,同时获得电能,装置如右图所示(电极均为惰性材料):
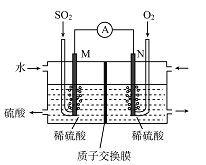
(1)M极发生的电极反应式为________________。
(2)若使该装置的电流强度达到2.0A,理论上每分钟应向负极通入标准状况下气体的体积为________L(已知:1个e-所带电量为1.6×10-19C)。
Ⅱ.溶液与电化学综合(钠碱循环法)处理SO2。
(3)钠碱循环法中,用Na2SO3溶液作为吸收液来吸收SO2,该反应的离子方程式为______________。
(4)吸收液吸收SO2的过程中,pH随n(SO32-)/n(HSO3-)变化关系如右图所示:
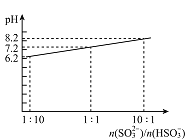
①用图中数据和变化规律说明NaHSO3溶液呈酸性的原因________________。
②n(SO32-)/n(HSO3-)=1:1时,溶液中离子浓度由大到小的顺序是_____________。
(5)当吸收液的pH降至约为6时,需送至电解槽处理,直至得到pH>8的吸收液再循环利用,其电解示意图如下:
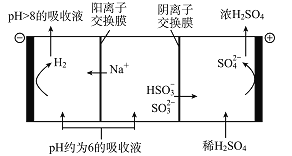
①写出阳极发生的电极反应式________________;
②当电极上有2 mol电子转移时阴极产物的质量为______________。
-
S02的含量是空气质量日报中一项重要检测指标,也是最近雾霾天气肆虐我国大部分地区的主要原因之一。加大S02的处理力度,是治理环境污染的当务之急。
I.电化学法处理SO2。
硫酸工业尾气中的SO2经分离后,可用于制备硫酸,同时获得电能,装置如右图所示(电极均为惰性材料):
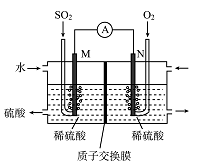
(1)M极发生的电极反应式为________________。
(2)若使该装置的电流强度达到2.0A,理论上每分钟应向负极通入标准状况下气体的体积为 L(已知:1个e所带电量为1.6×10-19C)。
Ⅱ,溶液与电化学综合(钠碱循环法)处理SO2。
(3)钠碱循环法中,用Na2SO3溶液作为吸收液来吸收SO2,该反应的离子方程式为 。
(4)吸收液吸收SO2的过程中,pH随n(SO32-)/n(HSO3-)变化关系如右图所示:
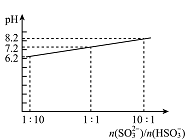
①用图中数据和变化规律说明NaHSO3溶液呈酸性的原因 。
②n(SO32-)/n(HSO3-)=1:1时,溶液中离子浓度由大到小的顺序是 。
(5)当吸收液的pH降至约为6时,需送至电解槽处理,直至得到pH>8的吸收液再循环利用,其电解示意图如下:
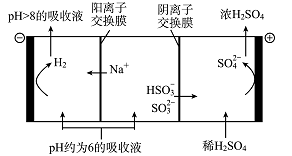
①写出阳极发生的电极反应式 ;
②当电极上有2 mol电子转移时阴极产物的质量为 。
-
(14分)近年来雾霾天气多次肆虐我国部分地区。其中燃煤和汽车尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g) + 2CO(g) 2CO2(g)+ N2(g) 。在密闭容器
2CO2(g)+ N2(g) 。在密闭容器
中发生该反应时,c(CO2)随温度(T)和时间(t)的变化曲线如图1所示。据此判断:
①该反应的△H 0(填“<”或“>”)。
②在T2温度下,0~2s内的平均反应速率v (N2)为 。
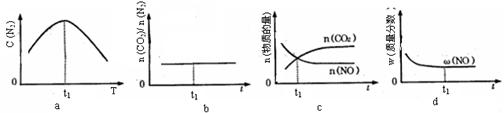
③若该反应在绝热、恒容的密闭体系中进行,下列图2中正确且能说明反应在进行到t1时刻达到平衡状态的是 (填字母编号)。
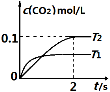

图1 图2
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。煤燃烧产生的烟气中含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol ①
2NO2(g) N2O4(g) △H=-56.9 kJ/mol ②
N2O4(g) △H=-56.9 kJ/mol ②
H2O(g)=H2O(l) △H=-44.0 kJ/mol ③
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式 。
(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解100mL 1 mol/L食盐
水的装置,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变)。
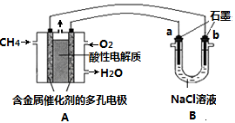
①该燃料电池的负极反应式为 。
②电解后溶液的pH约为 (忽略氯气与氢氧化钠溶液反应)。
③阳极产生气体的体积在标准状况下约为 L。
-
近年来雾霾天气多次肆虐我国中东部地区,其中汽车尾气和燃煤尾气是造成空气污染的原因之一。有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要。
(1)在汽车排气管内安装催化转化器,可将汽车尾气中主要污染物转化为无毒的大气循环物质。主要原理为:2NO(g)+2CO(g) 2CO2(g)+N2(g)。
2CO2(g)+N2(g)。
①该反应的平衡常数表达式为______________。
②在密闭容器中发生该反应时,c(CO2)随温度(T)和时间(t)的变化曲线如下图1所示。据此判断该反应的△H_______0(填“>”或“<”),在T1温度下,0〜2 s内N2的平均反应速率v(N2) =________。
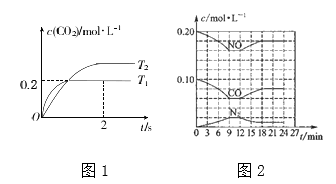
③将0.2mol NO和0.1mol CO充入一个容积为1L的密闭容器中,反应过程中物质浓度变化如上图2所示。第12min时改变的反应条件可能为______________。
A.升高温度 B.加入NO C.加催化剂 D.降低温度
(2)工业上常采用“低温臭氧氧化脱硫脱硝”技术来同时吸收氮的氧化物(NOx))和SO2气体,在此过程中还获得了(NH4)2SO4的稀溶液。
①在(NH4)2SO4溶液中,水的电离程度受到了_______(填“促进”、“抑制”或“没有影响)”
②若往(NH4)2SO4溶液中加入少量稀盐酸,则 值将_________(填“变大”、“变小”或“不变”)。
值将_________(填“变大”、“变小”或“不变”)。
(3)直接排放煤燃烧产生的烟气会引起严重的环境问题。
①煤燃烧产生的烟气中含有氮的氧化物,用CH4催化还原NOx可消除氮氧化物的污染。
已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867.0 kJ·mol-1
2NO2(g)  N2O4(g) △H = - 56.9 kJ·mol-1
N2O4(g) △H = - 56.9 kJ·mol-1
则CH4催化还原N2O4(g)生成N2和H2O(g)的热化学方程式为______________。
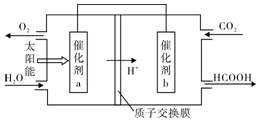
(2)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。下图是通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理示意图。电极b作______极,表面发生的电极反应式为________________。
-
2013年初,雾霾天气多次肆虐我国中东部地区。其中,汽车尾气和燃煤尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为: 。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如右图所示。
。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如右图所示。
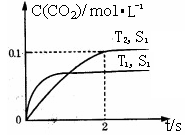
据此判断:
①该反应的△H________0(填“>”、“<”)。
②在T2温度下,0~2s内的平均反应速率v(N2)= ________ 。
③当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在上图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化曲线。
④若该反应在恒容的密闭体系中进行,下列示意图正确且能说明该反应进行到t1时刻达到平衡状态的是________ (填代号)
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
①煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOX可以消除氮氧化物的污染。
例如:
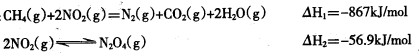
写出CH4 (g)催化还原N2O4(g)生成N2 (g)和H2O (g)的热化学方程式________。
②将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。右图是通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理示意图。催化剂b表面发生的电极反应式为________。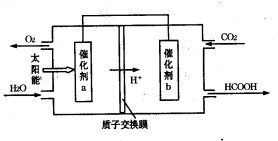
-
(11分)2013年雾霾天气多次肆虐我国中东部地区。其中,汽车尾气和燃煤尾气是造成空气污染的原因之一。
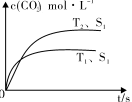
(1)汽车尾气净化的主要原理为:2NO(g)+2CO (g)  2CO2 (g) +N2 (g) 在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。
2CO2 (g) +N2 (g) 在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。
 据此判断:
据此判断:
①该反应的平衡常数表达式为 。
②该反应的ΔH 0(选填“>”、“<”)。
③当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在右
图中画出c(CO2)在T2、S2条件下达到平衡过程中的变化曲线。
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
①煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
CH4(g)+2NO2(g) = N2(g)+CO2(g)+2H2O(g)  =-867kJ·mol-1
=-867kJ·mol-1
2NO2(g)  N2O4(g)
N2O4(g)  =-56.9kJ·mol-1
=-56.9kJ·mol-1
写出CH4催化还原N2O4(g)生成N2(g)、CO2(g)和H2O(g)的热化学方程式 。
②将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。下图是通过光电转化原理以廉价原料制备新产品的示意图。
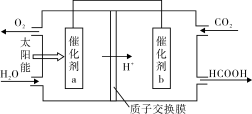
写出上述光电转化过程的化学反应方程式 。催化剂a、b之间连接导线上电子流动方向是 (填a→b或b→a)。



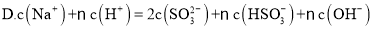











 。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如右图所示。
。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如右图所示。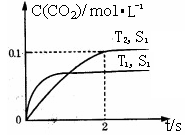

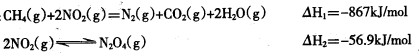

 据此判断:
据此判断: