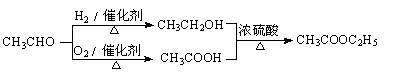-
北京晚报2010年7月26日报道,卫生部公布了《食用盐碘含量》的征求意见稿,面向
社会征求意见。对于食用盐中碘含量平均水平的规定有所降低。人类最早在食盐中添加的是KI,后来改为KIO3。下列有关说法正确的是
A.卫生部降低食用盐中碘含量的原因是碘对人体有害
B.厨房中食盐内的碘可用AgNO3溶液检验
C.目前食盐中添加的是KIO3而不是KI的原因是在空气中前者比后者稳定
D.反应 IO3-+5I-+6H+=3I2+3H2O中参加反应的H+的物质的量与转移电子的物质的量相等
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列叙述中正确的是
A.常温常压下,11.2LCH4中所含的原子总数大于2.5NA
. B.标准状况下,5.6 LCCl4中含有的共价键数目为NA
C.电解精炼铜时,若转移NA个电子,阳极溶解32g铜
D.常温常压下,1.7g羟基中含有的电子数为0.9NA
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是
A.等体积、等物质的量浓度的Ba(OH)2溶液与NaHCO3溶液混合:
Ba2++2OH-+2 HCO3-=BaCO3↓+CO32-+H2O
B.向次氯酸钙溶液中通入少量SO2气体:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
C.NH4HCO3溶液与足量NaOH溶液混合:NH4++HCO3-+2OH-=NH3·H2O+CO32-+H2O
D.向明矾溶液中加入过量的Ba(OH)2溶液:2Al3++3SO42-+3Ba2++6OH-=3BaSO4↓ +2Al(OH)3↓
难度: 简单查看答案及解析
-
香花石由前20号元素中的6种组成,其化学式为X3Y2(ZWR4)3T2,X、Y、Z为金属元素,Z的最外层电子数与次外层电子数相等,X、Z位于同主族,Y、Z、R、T位于同周期,R最外层电子数为次外层电子数的3倍,T无正价,X与R原子序数之和是W的2倍。下列说法错误的是
A.原子半径:Y>Z >R>T
B.气态氢化物的稳定性:W<R<T
C.最高价氧化物对应的水化物的碱性:X>Z
D.XR2和WR2两化合物中R的化合价相同
难度: 简单查看答案及解析
-
在固定容积的密闭容器中,放入a mol X,发生如下反应2X( ?)
Y(g)+Z(s),
并达到平衡状态,此时升高温度,气体的密度增大。下列叙述正确的是
A.压强的变化(可以通过改变容器的体积实现)对该平衡没有影响
B.若正反应为放热反应,则X一定为气态
C.若X为非气态,则正反应为放热反应
D.若X为气态,再向容器中充入a mol X,达到新平衡后,与第一次平衡相比,
X的体积分数增大
难度: 简单查看答案及解析
-
控制适合的条件,将反应2 Fe 3+ +2I-
2Fe2++I2设计成如下图所示的原电池。下列判断不正确的是
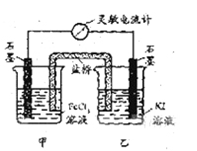
A. 反应开始时,乙中石墨电极上发生氧化反应
B. 电流计读数为零后,在甲中溶入FeCl2固体,
乙中石墨电极为负极
C. 反应开始时,甲中石墨电极上Fe3+被还原
D. 电流计读数为零时,反应达到化学平衡状态
难度: 简单查看答案及解析
-
现有碳酸钠、碳酸氢钠、氢氧化钠、氯化铁和苯酚五种物质的溶液,它们之间有如图所示转化关系,图中每条线两端的物质均可以发生反应,下列判断合理的是
A.X一定是碳酸氢钠溶液
B.Y不可能为氯化铁溶液
C.Z可能为氢氧化钠溶液
D.M、N必定各为苯酚、氢氧化钠溶液中的某一种
难度: 简单查看答案及解析
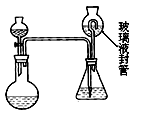
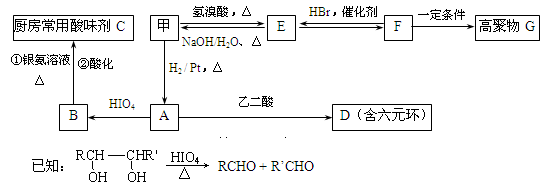 ①B的名称是________。
①B的名称是________。