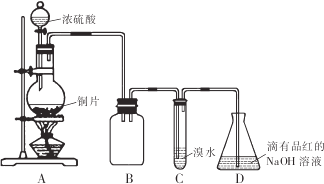
-
下列表述正确的是
A.1mol H2燃烧放出的热量为H2的燃烧热
B.稀豆浆、硅酸、氯化铁溶液均为胶体
C.NH4Br的电子式:

D.丙烯的结构简式:CH3CH=CH2
难度: 简单查看答案及解析
-
化学与生产、生活密切相关。下列叙述正确的是
A.明矾具有消毒杀菌作用,可用于净水
B.BaSO4在医学上用做钡餐,Ba2+对人体无毒
C.氢氧化铝常用于治疗胃酸过多
D.用催化法处理汽车尾气中的CO和NO:CO+NO
C+NO2
难度: 简单查看答案及解析
-
设NA为阿伏伽德罗常数值。下列说法正确的是
A.常温常压下,4.4g乙醛所含σ键数目为0.7NA
B.标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5 NA
C.12g石墨烯(单层石墨)中含有六元环的个数为0.5NA
D.50ml浓度为18.4mol·L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA
难度: 困难查看答案及解析
-
25℃时,下列各组离子在指定溶液中一定大量共存的是
A.甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl-
B.0.1mol/LNH4HCO3溶液中: K+、Na+、NO3-、Cl-
C.中性溶液中可能大量共存:Fe3+、K+、Cl-、SO42-
D.pH大于7的溶液:Na+、Ba2+、SO42-、 ClO--
难度: 中等查看答案及解析
-
短周期元素A、B、C、D(不考虑0族元素)的原子序数依次增大,且A、B、C+、D的最外层电子数与其电子层数的比值依次为2、3、4、2。下列关于这些元素叙述正确的是
A. C分别于A、D、B所形成的化合物中只有离子键
B. B分别于A、D两种元素所形成的化合物一定是直线形化合物
C. B、C、D所形成的简单离子半径大小顺序:D>B>C
D. D分别于B、C所形成的化合物,其水溶液均成酸性
难度: 中等查看答案及解析
-
已知酸性条件下KMnO4可将乙醛氧化为乙酸,其反应的离子反应方程式如下:□MnO4- + □CH3CHO + □ = □Mn2+ + □CH3COOH + □ .如有1mol的氧化剂参与反应,则反应中转移的电子数目为
A.2mol B.10mol C.5mol D.7mol
难度: 简单查看答案及解析
-
下列说法正确的是
A.离子化合物的熔点一定比共价化合物熔点高
B.甲烷的标准燃烧热为890.3KJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ·mol-1
C.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为N2(g)+3H2(g)
2NH3(g) △H=-38.6kJ·mol-1
D.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照条件和点燃条件下的△H相同
难度: 简单查看答案及解析
-
能正确表示下列反应的离子方程式的是
A.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+ 6H+ + 5H2O2= 2Mn2+ + 5O2↑ + 8H2O
B.向次氯酸钙溶液通入过量CO2:Ca2++2ClO-+CO2+H2O =CaCO3↓+2HClO
C.向次氯酸钙溶液通入SO2:Ca2++2ClO-+SO2+H2O= CaSO3↓+2HClO
D.FeBr2溶液与等物质的量的Cl2反应:2Fe2++ 2Br-+2Cl2=2Fe3++4Cl-+Br2
难度: 困难查看答案及解析
-
一种可充电电池镍氢电池在放电过程中的总反应方程式是:NiOOH+ MH =Ni(OH)2+ M(M位储氢材料)下列说法正确的是
A.NiMH 电池放电过程中,正极的电极反应式为:NiOOH + H2O + e-= Ni(OH)2 + OH-
B.充电过程中OH-离子从阳极向阴极迁移
C.充电过程中阴极的电极反应式:H2O + M + e-= MH+ OH-,H2O中的H被M还原
D.NiMH电池中可以HCl溶液作为电解质溶液
难度: 简单查看答案及解析
-
800℃在2L密闭容器内,充入0.020molNO与0.010mol的O2,发生反应2NO(g)+O2(g)
2NO2(g) n(NO)随时间的变化如表:
时间(s)
0
1
2
3
4
5
n(NO) (mol)
0.020
0.010
0.009
0.008
0.008
0.008

A.a线表示NO2的变化趋势,则0~2s内v(NO2)=0.006mol/(L·s)
B.800℃时,该反应的平衡常数K=1125L/mol
C.能使该反应的反应速率增大,且平衡向正方向移动的措施是及时分离出NO2
D.已知:K300℃>K350℃,则该反应时吸热反应
难度: 中等查看答案及解析
-
在一定温度下的定容容器中,当下列哪些物理量不再发生变化时,表明反应A(g)+2B(g)
C(g)+D(g)已达到平衡状态
①混合气体的压强
②混合气体的密度
③B的物质的量浓度
④混合气体总物质的量
⑤混合气体的平均相对分子质量
⑥v(C)与v(D)的比值
⑦混合气体总质量
⑧混合气体总体积
A.①②③④⑤⑥⑦⑧ B.①⑤⑧
C.②⑤⑦ D.①③④⑤
难度: 中等查看答案及解析
-
室温下,A、B两烧杯均盛有10mlpH=2的HA酸溶液,,向B烧杯中加水稀释至pH=3,关于A、B两烧杯中溶液的描述正确的是
A.水电离出的OH-浓度:10c(OH-)A> c(OH-)B
B.溶液的体积:10VA≤ VB
C.若分别用等浓度的氢氧化钠溶液完全中和,所得溶液的pH:A >B
D.若分别与10mLpH=12的氢氧化钠溶液反应,所得溶液的pH:A≤B
难度: 简单查看答案及解析
-
常温下,向100ml0.01mol/LHA的溶液中逐滴加入0.02mol/LMOH溶液,如图所示,曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计)。下列说法中不正确的是

A.HA为一元强酸,MOH为一元强碱
B.N点水的电离程度大于K点水的电离程度
C.滴入MOH溶液的体积为50ml时,c(M+)>c(A-)
D.K点时,则有c(MOH)+(M+)=0.02mol/L
难度: 困难查看答案及解析
-
向150ml 1mol/LNaOH溶液中通入标准状况下的CO2气体2.24L,待完全反应后,有关溶液中离子浓度的关系不正确的是
A.2c(OH-) + c(CO32-)=c(HCO3-) + 2c(H+) + 3c(H2CO3)
B.c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
C.c(Na+)>c(HCO3-)=c(CO32-)>c(H+)>c(OH-)
D.c(Na+)+ c(H+)=c(HCO3-) + 2c(CO32-) +c(OH-)
难度: 困难查看答案及解析
-
向密闭容器中充入物质A和B,发生反应aA(g)+bB(g)
cC(g).反应过程中,物质A的含量(A%)和C的含量(C%)随温度(T)的变化曲线如图所示,下列说法正确的是

A.该反应在T1、T3温度时达到过化学平衡
B.该反应在T2温度时达到过化学平衡
C.该反应的逆反应是放热反应
D.升高温度,平衡会向正反应方向移动
难度: 简单查看答案及解析
-
下列实验方案中,不能达到实验目的的是
选项
实验目的
实验方案
A
除去CO2气体中的SO2气体
将混合气体通入饱和碳酸氢钠溶液,洗气
B
检验Fe(NO3)2晶体是否已氧化变质
将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红
C
验证Br2的氧化性强于I2
强少量溴水加入KI溶液中,再加入CCl4,振荡,静置,可观察到下层液体呈紫色
D
验证Fe(OH)3的溶解度小于Mg(OH)2
将FeCl3溶液加入Mg(OH)2悬浊液中,振荡,可观察到沉淀由白色变为红色
难度: 困难查看答案及解析