-
化学与生产、生活、环境密切相关。下列有关说法正确的是
A. 酸雨的pH在5.6~7.0之间 B. 向海水中加入明矾可以使海水淡化
C. 硅太阳能电池与原电池的原理相同 D. CO2和CH4均能引起温室效应
难度: 中等查看答案及解析
-
下列关于有机化合物的说法正确的是
A. 乙苯的一氯代物只有5种
B. 2-甲基丁烷也称为新戊烷
C. 糖类、油脂、蛋白质均能发生水解反应
D. 丙烯与Cl2生成CH2=CH-CH2Cl的反应属于加成反应
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是
A. 17 g H2O2与17 g H2S所含的电子数均为9NA
B. 0. 3 mol NO2与水反应,生成H+数目为0.3NA
C. 0. 1 mol Cl2通入适量水中,转移电子数为0.2NA
D. 2 L pH =3的醋酸与足量的锌反应,产生H2分子数为10-3 NA
难度: 中等查看答案及解析
-
下列有关实验的说法正确的是
A. 测定中和反应反应热实验中,为了充分反应,应将NaOH溶液缓缓倒入盐酸中
B. 配制FeCl3溶液时,将FeCl3晶体溶解在较浓的盐酸中,再加蒸馏水稀释到所需浓度
C. 用盐酸滴定NaOH溶液时,左手控制酸式滴定管活塞,右手振荡锥形瓶,眼睛注视滴定管内液面
D. 检验Fe(NOs)2晶体是否变质时,将Fe(NO3)2样品溶于稀H2SO4后,再滴加KSCN溶液
难度: 困难查看答案及解析
-
W、X、Y、Z为原子序数依次增大的短周期主族元素,W的原子核外只有6个电子,X+和Y3+的电子层结构相同,Z-的电子数比Y3+多8个,下列叙述正确的是
A. W在自然界只有一种核素 B. 半径大小:X+>Y3+>Z-
C. Y与Z形成的化合物的水溶液呈弱酸性 D. X的最高价氧化物对应的水化物为弱碱
难度: 困难查看答案及解析
-
一种钌(Ru)配合物光敏太阳能电池工作原理及电池中发生的反应如下所示:
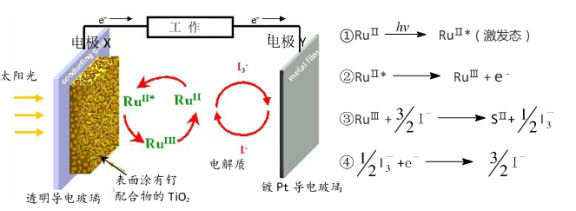
下列说法正确的是
A. 电极X为电池的正极 B. 电池工作时,电能转变为光能
C. 电池工作时,电极Y上发生还原反应 D. 电池的电解质溶液中I-和I3-的浓度不断减少
难度: 困难查看答案及解析
-
向0. 10 mol·L-1的Na2CO3溶液中逐滴加入稀盐酸,加入的HCl与原溶液中Na2CO3的物质的量之比f[f=
]与混合液pH的关系如图所示。下列说法正确的是

A. f=0时,溶液中:c(Na+)=2c(CO32-)
B. f=0.5时,溶液中:c(HCO3-)>c(CO32-)
C. f= 1时,溶液中:c(Na+) + c(H+) = 2c(CO32-) + c(HCO3-)+c(OH-)
D. f=2时,溶液中:1/2c(Na+)=c(CO32-)+c( HCO3-)+c(H2CO3)
难度: 困难查看答案及解析
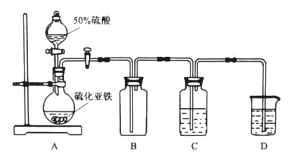
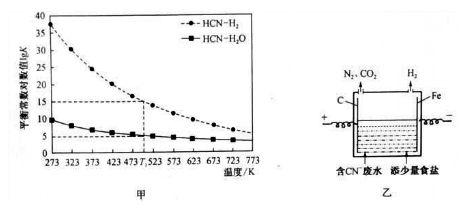
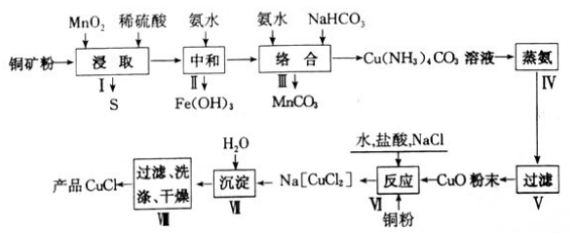
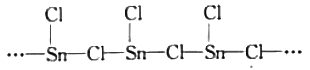


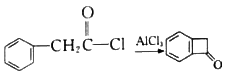 。结合上述流程中的信息,设计由制备
。结合上述流程中的信息,设计由制备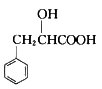 制备
制备 的合成路线:_______________________。
的合成路线:_______________________。