-
下列各组离子中,在碱性溶液中能大量共存,且溶液为无色透明的是
A.K+ MnO4- Cl- SO42- B.Na+ AlO2- Cl- SO42-
C.SO42- Na+ HCO3- Ba2+ D.Na+ NO3- NH4+ SO42-
难度: 中等查看答案及解析
-
下列物质能使品红溶液褪色,其中是利用强氧化性来漂白的是
①活性炭 ②过氧化钠 ③氯水 ④二氧化硫 ⑤臭氧
A.①③④ B.②③⑤ C.①②③④ D.①②③④⑤
难度: 中等查看答案及解析
-
下列事实与浓硫酸表现出的性质(括号中)对应关系正确的是
A.在空气中敞口久置的浓硫酸,溶液质量增大(挥发性)
B.在加热条件下铜与浓硫酸反应(脱水性)
C.浓硫酸在白纸上书写的字迹变黑(氧化性)
D.浓硫酸可用来干燥某些气体(吸水性)
难度: 中等查看答案及解析
-
以下非金属氧化物与其引起的环境问题及主要来源对应正确的是
氧化物
环境问题
主要来源
A
CO2
酸雨
化石燃料的燃烧
B
SO2
光化学烟雾
汽车尾气的排放
C
NO2
温室效应
工厂废气的排放
D
CO
CO中毒
燃料的不完全燃烧
难度: 中等查看答案及解析
-
不需要在棕色瓶中存放的物质是
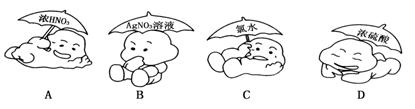
难度: 中等查看答案及解析
-
国家核事故应急协调委员会2011年4月4日权威发布:我国内地31个省、自治区、直辖市部分地区空气中监测到来自日本核事故释放出的极微量人工放射性核素131I。下列有关说法正确的是
A.131I与127I互为同素异形体。 B.131I比127I多4个质子
C.131I与127I是同一核素 D.131I与127I互为同位素
难度: 中等查看答案及解析
-
化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是
A.CO2的电子式
B.Cl-的结构示意图
C.氨分子的球棍模型:
D.质量数为37的氯原子Cl
难度: 中等查看答案及解析
-
北京2008奥运会金牌直径为70 mm,厚6 mm。某化学兴趣小组对金牌成分提出猜想:甲认为金牌是由纯金制造;乙认为金牌是由金银合金制成;丙认为金牌是由黄铜(铜锌合金)制成。为了验证他们的猜想,请你选择一种试剂来证明甲、乙、丙猜想的正误
A.硫酸铜溶液 B.氢氧化钠溶液 C.稀硝酸 D.硝酸银溶液
难度: 中等查看答案及解析
-
能正确表示下列反应的离子方程式是
A.向Fe(NO3)2稀溶液中加入盐酸: 3Fe2++4H++NO===3Fe3++NO↑+2H2O
B.铜片与浓HNO3: Cu+NO+4H+===Cu2++NO↑+2H2O
C.碳酸氢铵溶液与足量的NaOH溶液混合后加热: NH+OH-
NH3↑+H2O
D.AlCl3溶液中滴加足量氨水: Al3++4NH3·H2O===AlO+4NH+2H2O
难度: 中等查看答案及解析
-
“绿色化学实验”已走进课堂,下列做法符合“绿色化学”的是
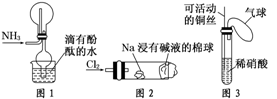
①实验室收集氨气采用图1所示装置
②实验室中做氯气与钠反应实验时采用图2所示装置
③实验室中用玻璃棒分别蘸取浓盐酸和浓氨水做氨气与酸生成铵盐的实验
④实验室中采用图3所示装置进行铜与稀硝酸的反应
A.②③④ B.①②③ C.①②④ D.①③④
难度: 中等查看答案及解析
-
向含有Cu(NO3)2、Zn(NO3)2、Fe(NO3)3、AgNO3各0.1 mol的混合溶液中加入0.1 molFe,充分搅拌后Fe溶解,溶液中不存在Fe3+,同时析出0.1 mol Ag.。下列结论错误的是
A.氧化性:Zn2+>Cu2+>Fe3+>Ag+ B.Fe3+的氧化性大于Cu2+
C.溶液中Cu2+与Fe2+的物质的量比为1∶2 D.1 mol Fe可还原2 mol Fe3+
难度: 中等查看答案及解析
-
类推思维是化学解题中常用的一种思维方法,下列有关离子方程式的类推正确的
已知
类推
A
将Fe加入CuSO4溶液中
Fe+Cu2+=Cu+Fe2+
将Na加入到CuSO4溶液中
2Na+Cu2+=Cu+2Na+
B
向稀硫酸加入NaOH溶液至中性
H++OH-=H2O
向H2SO4溶液加入Ba(OH)2溶液至中性
H++OH-=H2O
C
向氯化铝溶液中加入足量NaOH溶液
Al3+ + 4OH- = AlO2- + 2H2O
向氯化铝溶液中加入足量氨水
Al3+ + 4NH3·H2O = AlO2- + 2H2O +4NH4+
D
向Ca(OH)2溶液中通入过量CO2
CO2 + OH- = HCO3-
向Ca(OH)2溶液中通入过量SO2
SO2 + OH- = HSO3-
难度: 中等查看答案及解析
-
下列叙述中正确的是
A.除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数
B.除短周期外,其他周期均有18种元素
C.在同一周期中,ⅠA族比ⅡA族的单质与水反应更剧烈
D.在ⅠA族中,单质的熔、沸点随着原子半径的增大而逐渐升高
难度: 中等查看答案及解析
-
下表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是
A.常压下五种元素的单质中Z单质的沸点最高
B.Y、Z的阴离子电子层结构都与R原子的相同
C.W的氢化物的沸点比X的氢化物的沸点高
D.Y元素的非金属性比W元素的非金属性强
难度: 中等查看答案及解析
-
几种短周期元素的原子半径及主要化合价如下表:
元素代号
L
M
Q
R
T
原子半径/nm
0.160
0.143
0.102
0.089
0.074
主要化合价
+2
+3
+6、-2
+2
-2
下列叙述正确的是
A.L、M的单质与稀硫酸反应速率:M>L
B.R的氧化物对应的水化物可能具有两性
C.T、Q的氢化物常态下均为无色气体
D.L、Q形成的简单离子核外电子数相等
难度: 中等查看答案及解析
-
下列各组物质的晶体中,化学键类型相同、晶体类型、物质发生状态变化所克服的粒子间的相互作用也相同的是
A.SO3和HCl B.KCl和Mg C.NaCl和H2O D.CCl4和SiO2
难度: 中等查看答案及解析
-
将SO2和X气体分别通入BaCl2溶液中,未见沉淀生成,若同时通入,有沉淀生成,则X气体不可能是
A.CO2 B.NH3 C.Cl2 D.H2S
难度: 中等查看答案及解析
-
把SO2通入Fe(NO3)3溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色,此时若滴入BaCl2溶液,则会产生白色沉淀。在上述一系列变化过程中,最终被还原的是
A.SO2 B.Fe2+ C.Fe3+ D.NO
难度: 中等查看答案及解析
-
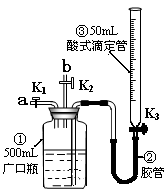
如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准)。则下列有关说法正确的是

A.蓝色石蕊试纸先变红后褪色
B.品红试纸、沾有KMnO4溶液的滤纸均褪色证明了SO2具有漂白性
C.湿润淀粉KI试纸变蓝说明SO2的氧化性弱于I2
D.NaOH溶液可用于除去实验中多余的SO2
难度: 中等查看答案及解析
-
含8.0g NaOH的溶液中通入一定量H2S后,将得到的溶液小心蒸干,称得无水物7.9g,则该无水物中一定含有的物质是
A、Na2S B、NaHS C、Na2S和NaHS D、NaOH和NaHS
难度: 中等查看答案及解析
-
下列实验过程中产生的现象与对应的图形相符合的是

难度: 中等查看答案及解析
-
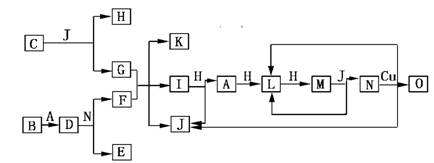
下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他反应产物及反应所需条件均已略去),当X是强碱时,过量的B跟Cl2反应除生成C外,另一产物是盐酸盐。
下列说法中不正确的是
A.当X是强酸时,A、B、C、D、E、F中均含同一种元素,F可能是H2SO4
B.当X是强碱时,A、B、C、D、E、F中均含同一种元素,F是HNO3
C.B和Cl2的反应是氧化还原反应
D.当X是强酸时,C在常温下是气态单质
难度: 中等查看答案及解析
-
将NO2、NH3、O2的混合气体26.88 L通过稀硫酸后,溶液质量增加45.75 g,气体体积缩小为2.24 L,将带火星的木条插入其中,木条不复燃。则原混合气体的平均相对分子质量为(气体体积均在标准状况下测定)
A.31.667 B.35.785 C.38.125 D.40.625
难度: 中等查看答案及解析
-
向m g镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体b L。向反应后的溶液中加入c mol/L氢氧化钾溶液V mL,使金属离子刚好沉淀完全,得到的沉淀质量为n g。再将得到的沉淀灼烧至质量不再改变为止,得到固体p g。则下列关系不正确的是
A.
B.
C.n=m+17Vc D.
<
<
难度: 中等查看答案及解析
-
已知单质铁溶于一定浓度的硝酸溶液中反应的离子方程式为:aFe+bNO3-+cH+=dFe2++fFe3++gNO↑+hN2O↑+kH2O(化学计量数均为正整数)。若a=12,且铁与硝酸恰好完全反应,则b的取值范围
A.6<b<12 B.30<b<48 C.8<b<12 D. 6<b<9
难度: 中等查看答案及解析