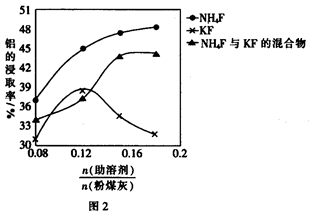
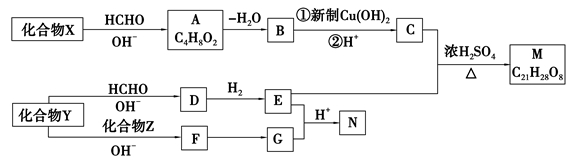
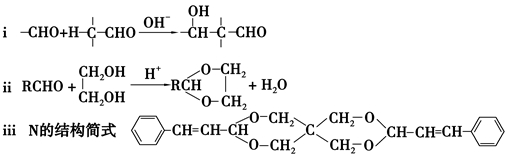
-
化学与生产、生活、环境关系密切,下列说法正确的是
A.提倡使用太阳能、风能、天然气、地热能等新能源,以保护环境
B.“玉兔号”的太阳能电池板主要由二氧化硅制成
C.为除去锅炉水垢中的CaSO4,可先用饱和Na2CO3溶液浸泡,再加盐酸溶解
D.碱性洗涤剂的去污能力比中性洗涤剂弱,是由于油脂在中性溶液中更易水解
难度: 中等查看答案及解析
-
下列实验操作一定能够达到目的的是
A.向某溶液中滴加盐酸酸化的Ba(NO3)2溶液,有白色沉淀生成,则该溶液中一定含有
B.用饱和NaHCO3溶液除去CO2气体中混有的少量SO2
C.将产生的气体依次通过足量的溴水和澄清石灰水,检验浓H2SO4与木炭反应生成的气体产物
D.实验室制取氢气,为了加快反应速率,可向稀硫酸中滴加少量Cu(NO3)2
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A.向FeBr2溶液中通入少量Cl2:Cl2+2Br-
2Cl-+Br2
B.除去MgCl2溶液中少量的FeCl3:3Mg+2Fe3+
2Fe+3Mg2+
C.向含有氨水的BaCl2溶液中通入SO2:SO2+ 2NH3·H2O + Ba2+=== BaSO3↓+2 NH4+ +2H2O
D.将少量二氧化碳通入溶液中:Ca2++CO2+H2O
CaCO3+2H+
难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数的值,下列说法不正确的是
A.5.6g铁粉与7.1gCl2充分反应,转移电子数0.3NA
B.1.7g羟基与1.6g甲烷分子所含电子数分别是0.9NA和NA
C.3molNO2与水充分反应时转移电子数2NA
D.87gMnO2与含4NAHCl的浓盐酸加热反应,生成的氯气在标准状况下体积小于22.4L
难度: 中等查看答案及解析
-
下列说法正确的是
A.常温下,0.1mol/LHA溶液与0.1mol/LNaOH溶液等体积混合,测得混合溶液pH=8,则混合溶液中水电离产生的c(OH-)=110-8
B.室温下,CH3COONa和CaCl2的混合溶液:c (Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+c(Cl-)
C.恒容密闭容器中进行反应2A2(g)+B2(g)
2A2B(g) ,达到化学平衡后,加热会使逆反应速率大于正反应速率
D.常温下,pH=11的氨水和pH=1的盐酸等体积混合,恰好完全反应,则混合溶液中c(NH4+)+c(NH3∙H2O)+c(NH3)=5×10-4mol/L
难度: 困难查看答案及解析
-
奎尼酸是制备艾滋病新药二咖啡酰奎尼酸的原料,其结构简式如图,下列有关奎尼酸的说法中正确的是
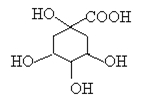
A.奎尼酸的分子式是C7H9O6
B.1mol奎尼酸与足量NaOH溶液反应,最多消耗NaOH物质的量为5mol
C.1 mol奎尼酸与足量钠反应生成56L氢气
D.奎尼酸能发生消去反应,也能与乙醇、乙酸发生取代反应
难度: 中等查看答案及解析
-
原子序数依次增大的X、Y、Z、W四种短周期元素,X原子的最外层电子数与其电子层数相等,工业上一般用电解氧化物的方法得到Z的单质,W的核电荷数是Y核电荷数的2倍,X、Y两种元素可以形成原子数之比为1:1和2:1的化合物。下列说法正确的是
A.由X、Y、Z组成的化合物既能与强碱溶液反应,又能与强酸溶液反应
B.W的氢化物水溶液是强酸
C.Y元素的氢化物在同周期中是最稳定的
D.元素Y和W只能形成一种化合物
难度: 中等查看答案及解析
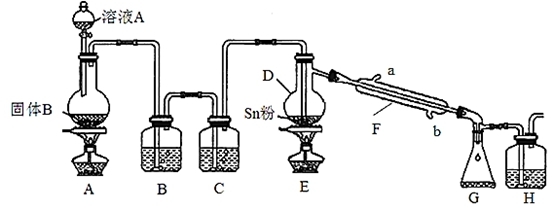
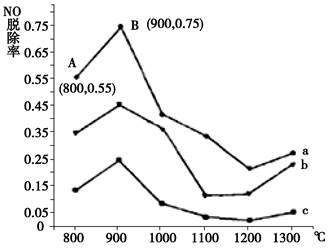
 CO2(g) + H2(g)。
CO2(g) + H2(g)。