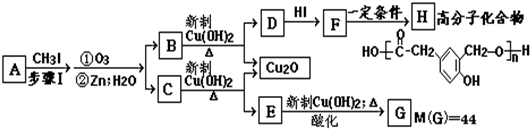
-
下列排列顺序正确的是( )
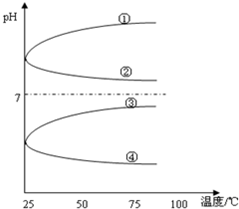
①固体热稳定性:Na2CO3>CaCO3>NaHCO3
②微粒半径:F->Na+>Mg2+>S2-
③燃烧热:S(气体)>S(液体)>S(固体)
④物质的沸点:SiO2>KCl>H2O>H2S⑤物质的熔点:植物油>动物油.
A.①③④
B.①③④⑤
C.①②③④
D.②③④⑤难度: 中等查看答案及解析
-
化学与生产、生活、社会密切相关.下列有关说法中不正确的是( )
A.“光化学烟雾”、“臭氧层空洞”、“温室效应”、“硝酸型酸雨”的形成都与氮氧化合物有关
B.有些肾病患者要定期进行血透,血透的原理是利用渗析的方法净化血液
C.2009年诺贝尔物理学奖授予华裔科学家高锟,是因其在光纤材料领域取得了卓越贡献.光纤的成分与玛瑙的主要成分相同,通常情况下不与强氧化剂和强酸反应
D.建国60周年庆典晚会上,天安门广场燃放的焰火是某些金属元素魅力的展现难度: 中等查看答案及解析
-
若NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
A.1mol含8个碳原子的某烃分子,最多形成8NA个碳碳单键
B.在含有NA个醋酸根离子(CH3COO-)的醋酸溶液中氢离子数目为NA
C.1molCl2发生反应时,转移的电子数一定是2NA
D.16.9g过氧化钡(BaO2)固体中阴、阳离子总数为0.2NA难度: 中等查看答案及解析
-
下列关于图所示装置的说法中,正确的是( )
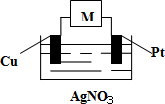
A.若M是电流计,则该装置可以将电能转化为化学能
B.若M是直流电源,一段时间后铜棒上可以镀上铂
C.若M是直流电源,当有1.12L(标准状况)气体生成时,电路中转移了0.2mole-
D.M无论是电流计还是直流电源,该装置中都有反应Ag++e-=Ag 发生难度: 中等查看答案及解析
-
下列用来表示物质变化的化学反应中.正确的是( )
A.表示中和热的热化学方程式:H++OH-=H2O△H=-57.3kJ•mol-l
B.硫酸氢铵溶液与少量氢氧化钠溶液混合共热的离子方程式:NH4++OH-NH3↑+H2O
C.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4的离子方程式:3C1O-十2Fe(OH)3=2FeO42-+3C1-+H2O+4H+
D.高锰酸钾酸性溶液与双氧水反应的离子方程式:2MnO4-+5H2l8O2+6H+=2Mn2++518O2↑+8H2O难度: 中等查看答案及解析
-
某有机物A的结构简式如右图所示,下列有关叙述正确的是( )

A.1molA最多可以与2molBr2发生反应
B.A在一定条件下可以发生消去反应和取代反应
C.一个A分子中最多有8个碳原子在同一平面上
D.1molA与足量的NaOH溶液反应,最多可以消耗3molNaOH难度: 中等查看答案及解析
-
已知溶液中:还原性HSO3->I-,氧化性:IO3->I2>SO42-.在含3mol NaHSO3的溶逐滴加入KIO3溶液,加入KIO3和析出I2的物质的量的关系如图所示,则下列说法错误的是( )
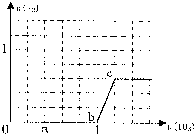
A.a点时NaHSO3过量
B.b点时还原产物为I-
C.b点到c点,KIO3与NaHSO3反应生成I2
D.加入的KIO3为0.4mol或1.12mol时,I-均为0.4mol难度: 中等查看答案及解析
-
某兴趣小组为探究外界条件对可逆反应 A(g)+B(g)
C(g)+D(s)的影响,在恒温条件下往一个容积为10L的密闭容器中充入1molA和1molB,反应达平衡时测得容器中各物质的浓度为I然后每次改变一种反应条件做了另三组实验,重新达到平衡时容器中各成分的浓度(其中D用物质的量来表达)分别为Ⅱ.Ⅲ.Ⅳ.
针对上述系列试验,下列结论中正确的是( )A B C D Ⅰ 0.05mol•L-1 a mol•L-1 0.05mol•L-1 b mol Ⅱ 0.078mol•L-1 0.078mol•L-1 0.122mol•L-1 m mol Ⅲ 0.06mol•L-1 0.06mol•L-1 0.04mol•L-1 n mol Ⅳ 0.07mol•L-1 0.07mol•L-1 0.098mol•L-1 p mol
A.Ⅰ中a=1
B.实验Ⅳ结果的产生可能是因为采用从生成物配比的方法,且p≥0.98
C.Ⅱ对应的操作方法可以是在Ⅰ的基础上压缩反应容器的体积,且m>0.5
D.将Ⅲ与I比较,可以判断出正反应一定是放热反应难度: 中等查看答案及解析