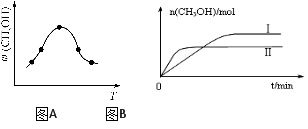
-
化学与能源、环保、资源利用、食品安全等密切相关,下列说法正确的是( )
A.石油液化气、汽油和石蜡的主要成分都是碳氢化合物
B.核电站泄漏的放射性碘-131
、铯-137
互称同位素,可使蛋白质变性
C.某雨水样品放置一段时间后pH由4.68变为4.28,是因为水中溶解的CO2增多
D.“地沟油”、“塑化剂”(邻苯二甲酸酯类物质)均属于高分子化合物,都对健康有害。
难度: 中等查看答案及解析
-
以NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.0.1mol Fe与足量盐酸反应,转移的电子数为0.3NA
B.28gCO中所含的原子数为2NA
C.1L 0.1mol/LNa2CO3溶液中,含有CO32— 数为0.1NA
D.22.4LH2的分子数为NA
难度: 中等查看答案及解析
-
下列离子反应方程式正确的是( )
A.氨水吸收过量的SO2:OH-+SO2=HSO3-
B.FeSO4溶液被氧气氧化:4Fe2++O2+2H2O=4Fe3++4OH-
C.NaAlO2溶液中加入过量稀硫酸:AlO2-+H++H2O=Al(OH)3↓
D.Cl2与稀NaOH溶液反应:Cl2+2OH-=Cl-+ClO-+ H2O
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Y原子的最外层电子数是其电子层数的3倍。下列说法正确的是( )
A.元素W的最高价氧化物对应水化物的酸性最强
B.单核阴离子半径的大小顺序为:r(W)>r(Z) >r(Y)
C.元素Y和元素Z的氢化物中均只存在极性共价键
D.元素Y和元素Z的最高正化合价相同
难度: 中等查看答案及解析
-
下列实验操作或事实与预期实验目的或所得结论一致的是( )
选项 实验操作或事实 实验目的或结论
A 取少量试液于试管中,加入用HNO3酸化的BaCl2溶液,产生白色沉淀 说明试液中一定含有SO42-
B 分别向两支试管中加入等体积、等浓度的过氧化氢溶液,再在其中一支试管中加入少量MnO2 研究催化剂对过氧化氢分解速率的影响
C 将NaHCO3与HCl两种溶液相互滴加 可以鉴别这两种溶液
D C2H5Br与AgNO3溶液混合加热 检验C2H5Br中的溴元素
难度: 中等查看答案及解析
-
下列说法都正确的是( )
①江河入海口三角洲的形成通常与胶体的性质有关 ②建筑使用了大量钢材,钢材是合金 ③“钡餐”中使用的硫酸钡是弱电解质 ④太阳能电池板中的硅在元素周期表中处于金属与非金属的交界位置 ⑤常用的消毒剂有氯气和二氧化硫,两者都有强氧化性 ⑥水陆两用公共汽车中,用于密封的橡胶材料是高分子化合物
A.①②③④ B.①②④⑥ C.①②⑤⑥ D.③④⑤⑥
难度: 中等查看答案及解析
-
下列实验装置设计正确、且能达到目的的是( )
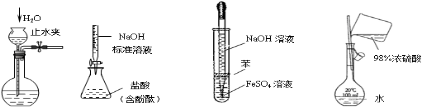
Ⅰ Ⅱ Ⅲ Ⅳ
A.实验I: 检查装置的气密性
B.实验II:测定未知盐酸的浓度
C.实验III:制取并观察Fe(OH)2沉淀
D.实验IV:配置一定的物质的量浓度的稀硫酸溶液
难度: 中等查看答案及解析
-
下列各溶液中,微粒的物质的量浓度关系正确的是( )
A.常温下,将pH=2的盐酸和pH=12的氨水等体积混合后:c(NH4+)>c(Cl-)> c(OH-)>c(H+)
B.0.1 mol·L-1 Na2CO3溶液:c(Na+)=2c(HCO3-)+2c(CO32¯)+2c(H2CO3)
C.0.1 mol·L-1 NH4Cl溶液:c(NH4+)=c( Cl-)
D.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液: c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
难度: 中等查看答案及解析