-
下列各组离子在指定溶液中能大量共存的是 ( )
①无色溶液中:K+、Cl-、NO3-、MnO4-
②pH=11的溶液中:CO32-、Na+、S2-、SO32-
③水电离的c(H+)=1×10-13mol/L的溶液中:Cl-、HCO3-、NH4+、S2O32-
④加入能放出H2的溶液中:Mg2+、NH4+、K+、Cl-
⑤酸性溶液中:Fe2+、NO3-、I-、Al3+
难度: 中等查看答案及解析
-
下列叙述错误的是 ( )
A.分子式为C5H12的烃,其一氯代物有3种
B.淀粉、油脂、蛋白质都能水解,但水解产物不同
C.煤油可由石油分馏获得,可用作燃料和保存少量金属钠
D.苯乙烯分子中所有原子可能在同一平面上
难度: 中等查看答案及解析
-
在通常条件下,下列各组物质的性质排列顺序正确的是: ( )
A.熔点:CO2>KCl>SiO2 B.水溶性:HCl>H2S>SO2
C.沸点:乙烷>戊烷>丁烷 D.热稳定性:HF>H2O>NH3
难度: 中等查看答案及解析
-
下列热化学方程式中,正确的是: ( )
A.甲烷的燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:
CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3 kJ·mol-1
B.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:
N2(g)+3H2(g)
2NH3(g) △H=-38.6 kJ·mol-1
C.HCl和NaOH反应的中和热△H=-57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热
△H=2×(-57.3)kJ·mol-1
D.在101 kPa时,2gH2完全燃烧生成液态水,放出285.8lkJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(1)△H=-571.6 kJ·mol-1
难度: 中等查看答案及解析
-
在80g密度为d g/cm3的硫酸铁溶液中,含有2.8gFe3+离子,则此溶液中SO42-的物质的量浓度为: ( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
下列反应中,不属于取代反应的是: ( )
A.在催化剂存在条件下苯与溴反应制溴苯
B.苯与浓硝酸、浓硫酸混合共热制取硝基苯
C.在催化剂存在条件下,乙烯与氯化氢反应制氯乙烷
D.油脂在碱性条件下水解制肥皂
难度: 中等查看答案及解析
-
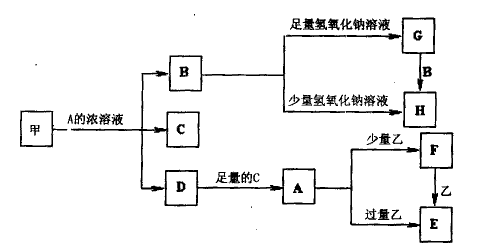
A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X,它们有如图所示的转化关系(部分产物及反应条件已略去)。下列推断正确的是: ( )
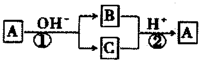
A.X元素为铝
B.反应①和②互为可逆反应
C.X元素可能是金属,也可能是非金属
D.反应①和②一定为氧化还原反应
难度: 中等查看答案及解析