-
已知X、Y、Z、W、K五种元素均位于周期表的前四周期,且原子序数依次增大。元素X是周期表中原子半径最小的元素;Y的基态原子中电子占据了三种能量不同的原子轨道,且这三种轨道中的电子数相同;W位于第2周期,其原子的核外成对电子数是未成对电子数的3倍;K位于ds区且原子的最外层电子数与X的相同。
请回答下列问题:(答题时,X、Y、Z、W、K用所对应的元素符号表示)
(1)Y、Z、W元素的第一电离能由大到小的顺序是 。
(2)K的电子排布式是 。
(3)Y、Z元素的某些氢化物的分子中均含有18个电子,则Y的这种氢化物的化学式是 ;Y、Z的这些氢化物的沸点相差较大的主要原因是
(4)若X、Y、W形成的某化合物(相对分子质量为46)呈酸性,则该化合物分子中Y原子轨道的杂化类型是 ;1 mol该分子中含有 σ键的数目是 。
(5)Z、K两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是 ,Z原子的配位数是 。
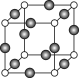
高三化学填空题困难题查看答案及解析
-
已知X、Y、Z、W、K五种元素均位于周期表的前四周期,且原子序数依次增大。元素X是周期表中原子半径最小的元素;Y的基态原子中电子占据了三种能量不同的原子轨道,且这三种轨道中的电子数相同;W位于第2周期,其原子的核外成对电子数是未成对电子数的3倍;K位于ds区且原子的最外层电子数与X的相同。
请回答下列问题:(答题时,X、Y、Z、W、K用所对应的元素符号表示)
⑴Y、Z、W元素的第一电离能由大到小的顺序是 。
⑵K的二价离子电子排布式是 。
⑶Y、Z元素的某些氢化物的分子中均含有18个电子,则Y的这种氢化物的化学式是 ;Y、Z的这些氢化物的沸点相差较大的主要原因是 。
⑷若X、Y、W形成的某化合物(相对分子质量为46)呈酸性,则该化合物分子中Y原子轨道的杂化类型是 ;1 mol该分子中含有 σ键的数目是 。
⑸Z、K两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是 ,Z原子的配位数是 。
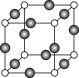
高三化学填空题困难题查看答案及解析
-
A、B、C、E、F为原子序数依次增大的六种元素,其中A、B、C、D、E为短周期元素,F为第四周期元素,F还是前四周期中电负极最小的元素。
已知:
A原子的核外电子数与电子层数相等;
B元素原子的核外p电子数比s电子数少1个;
C原子的第一至第四电离能为I1=738 kJ/mol,I2=1451 kJ/mol,I3=7733 kJ/mol,I4=10540 kJ/mol;
D原子核外所有p轨道为全充满或半充满;
E元素的族序数与周期序数的差为4;
(1)写出E元素在周期表位置:________;D元素的原子的核外电子排布式:____________________。
(2)某同学根据题目信息和掌握的知识分析C的核外电子排布为
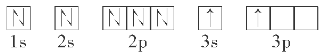
该同学所画的轨道式违背了________。
(3)已知BA5为离子化合物,写出其电子式:______________。
(4)DE3中心原子杂化方式为__________________,其空间构型为______________。
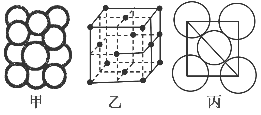
(5)某金属晶体中原子堆积方式如图甲,晶胞特征如图乙,原子相对位置关系如图丙,则晶胞中该原子配位数为________;空间利用率为________;该晶体的密度为________。(已知该金属相对原子质量为m,原子半径为a cm)
高三化学填空题困难题查看答案及解析
-
已知A、B、C、D、E、F为周期表前四周期原子序数依次增大的六种元素。其中A是元素周期表中原子半径最小的元素,B原子最外层电子数是内层电子数的2倍。D、E为同主族元素,且E的原子序数为D的2倍。F元素在地壳中含量位于金属元素的第二位。试回答下列问题:
(1)F元素价层电子排布式为___________________。
(2)关于B2A2的下列说法中正确的是 ________________。
A.B2A2中的所有原子都满足8电子结构
B.每个B2A2分子中σ键和π键数目比为1∶1
C.B2A2是由极性键和非极性键形成的非极性分子
D.B2A2分子中的B-A键属于s—spσ键
(3) B和D形成的一种三原子分子与C和D形成的一种化合物互为等电子体,则满足上述条件的B和D形成的化合物的空间构型是________________。
(4) C元素原子的第一电离能比B、D两元素原子的第一电离能高的主要原因__________。
(5) A与D可以形成原子个数比分别为2∶1,1∶1的两种化合物X和Y,其中 Y含有____________键(填“极性键”“非极性键”),A与C组成的两种化合物M和N所含的电子数分别与X、Y相 等,N的 结构式为________。
(6) E的氢化物的价层电子对互斥理论模型为________,E 原子的杂化方式为________杂化。
(7) F单质的晶体在不同温度下有两种堆积方式,晶胞分别如右图所示。面心立方晶胞和体心立方晶胞的棱边长分别为acm、bcm,则F单质的面心立方晶胞和体心立方晶胞的密度之比为_________,F原子配位数之比为__________________。
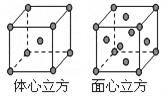
高三化学综合题简单题查看答案及解析
-
已知A、B、C、D、E、F为周期表前四周期原子序数依次增大的六种元素。其中A是元素周期表中原子半径最小的元素,B原子最外层电子数是内层电子数的2倍。D、E为同主族元素,且E的原子序数是D的2倍。F元素在地壳中含量位于金属元素的第二位。回答下列问题:
(1)F元素价层电子排布式为 。
(2)关于B2A2的下列说法中正确的是
A.B2A2 中的所有原子都满足8电子结构
B.每个B2A2分子中
键和
键数目比为1:1
C.B2A2 是由极性键和非极性键形成的非极性分子
D.B2A2分子中的A—B键属于
—
键
(3)B和D形成的一种三原子分子与C和D形成的一种化合物互为等电子体,则满足上述条件的B和D形成的化合物的结构式为
(4)C元素原子的第一电离能比B、D两元素原子的第一电离能都高的主要原因是
(5)D的氢化物比E的氢化物沸点高,其主要原因是 ;E的氢化物的价层电子对互斥模型为 ,E原子的杂化方式为 。
(6)F单质的晶体在不同温度下有两种堆积方式,即面心立方堆积和体心立方堆积,其晶胞的棱边长分别为a cm、b cm,则F单质的这两种晶体密度之比为 ,F原子的配位数之比为 。
高三化学填空题困难题查看答案及解析
-
已知A、B、C、D、E、F为周期表前四周期原子序数依次增大的六种元素。其中A是元素周期表中原子半径最小的元素,B原子最外层电子数是内层电子数的2倍。D、E为同主族元素,且E的原子序数为D的2倍。F元素在地壳中含量位于金属元素的第二位。试回答下列问题:
(1)F元素价层电子排布式为 _______________。
(2)关于B2A2的下列说法中正确的是 _________________。
A. B2A2中的所有原子都满足8电子结构
B. 每个B2A2分子中σ键和π键数目比为1:1
C. B2A2是由极性键和非极性键形成的非极性分子
D. B2A2分子中的B-A键属于s —spσ键
(3)B和D形成的一种三原子分子与C和D形成的一种化合物互为等电子体,则满足上述条件的B和D形成的化合物的空间构型是 ___________________。
(4)C元素原子的第一电离能比B、D两元素原子的第一电离能高的主要原因 _____________________________。
(5)A与D可以形成原子个数比分别为2:1,1:1的两种化合物X和Y,其中 Y含有__________键(填“极性键”“非极性键”),A与C组成的两种化合物M和N所含的电子数分别与X、Y相等, N的结构式为__________。
(6)E的氢化物的价层电子对互斥理论模型为 _______,E 原子的杂化方式为 ________杂化。
(7)F单质的晶体在不同温度下有两种堆积方式,晶胞分别如右图所示。面心立方晶胞和体心立方晶胞的棱边长分别为acm、bcm,则F单质的面心立方晶胞和体心立方晶胞的密度之比为____________,F原子配位数之比为__________________。
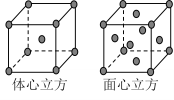
高三化学简答题简单题查看答案及解析
-
(题文)X、Y、Z、W、M五种元素的原子序数依次增大。已知X、Y、Z、W是短周期元素中的四种非金属元素,X元素的原子形成的离子就是一个质子;Y原子的最外层电子数是内层电子数的2倍;Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体;M是地壳中含量最高的金属元素。下列说法正确的是( )
A. X、Z、W三元素形成的化合物为共价化合物
B. 五种元素的原子半径从大到小的顺序是:M>W>Z>Y>X
C. 化合物YW2、ZW2都是酸性氧化物
D. 用M单质作阳极,石墨作阴极电解NaHCO3溶液,在阳极区出现白色沉淀
高三化学单选题简单题查看答案及解析
-
已知X、Y、Z、W四种元素是元素周期表中连续三个短周期的元素,且原子序数依次增大.X、W同主族,Y、Z为同周期的相邻元素.W原子的核外电子数等于Y、Z原子最外层电子数之和.Y的氢化物分子中有3个共价键.Z原子最外层电子数是次外层电子数的3倍,试推断:
(1)X、Z二种元素的元素符号:X______;Z______.
(2)由以上元素中的两种元素组成的能溶于水且水溶液显碱性的化合物的电子式分别为______、______、______.
(3)由X、Y、Z所形成的常见离子化合物是______,它与W的最高价氧化物的水化物的浓溶液加热时反应的离子方程式______ NH3↑+H2O高三化学解答题中等难度题查看答案及解析
-
X、Y、Z、W、M五种元素的原子序数依次增大。已知X、Y、Z、W是短周期元素中的四种非金属元素,X元素的原子形成的离子就是一个质子;Y原子的最外层电子数是内层电子数的2倍;Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体;M元素的原子是短周期中原子半径最大的。下列说法正确的是
A. X、Z、W三元素形成的化合物都是共价化合物
B. 简单离子的半径从大到小的顺序是:M>Y>Z>W
C. 氢化物的稳定性强弱顺序为:Y>Z>W
D. M2W2既含有离子键,也含有非极性键
高三化学单选题中等难度题查看答案及解析
-
X、Y、Z、W、M五种元素的原子序数依次增大。已知X、Y、Z、W是短周期元素中的四种非金属元素,X元素的原子形成的离子就是一个质子;Y原子的最外层电子数是内层电子数的2倍;Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体;M是地壳中含量最高的金属元素。下列说法正确的是( )
A. X、Z、W三元素形成的化合物为共价化合物
B. 五种元素的原子半径从大到小的顺序是:M>W>Z>Y>X
C. 化合物YW2、ZW2都是酸性氧化物
D. 用M单质作阳极,石墨作阴极电解NaHCO3溶液,在阳极区出现白色沉淀
高三化学单选题简单题查看答案及解析