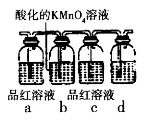
-
化学与生产、生活密切相关。下列说法错误的是
A.二氧化氮能使织物褪色,对金属材料也有腐蚀作用
B.纯碱是制作面包等糕点的膨松剂,也是治疗胃酸过多的一种药剂
C.“水滴石穿”是因为CaCO3与CO2、水发生了化学反应
D.因为氨易液化,在汽化时会吸收大量的热量,所以可作制冷剂
难度: 简单查看答案及解析
-
下列说法中正确的是
A.干冰、液态氯化氢都是电解质
B.Na2O2晶体中既含有离子键又含有共价键
C.Na2O、Fe2O3、Al2O3既属于碱性氧化物,又属于离子化合物
D.根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体
难度: 简单查看答案及解析
-
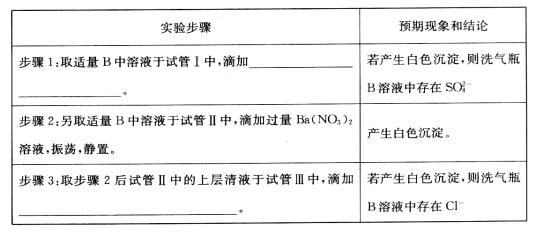
实验室中以下物质的贮存方法,不正确的是
A.保存硫酸亚铁溶液时,向其中加入铁钉和少量硫酸
B.少量金属钠保存在煤油中
C.少量液溴可用水封存,防止溴挥发
D.浓硝酸用带橡胶塞的细口、棕色试剂瓶盛放,并贮存在阴凉处
难度: 简单查看答案及解析
-
下列有关实验的做法错误的是
A.用苯从溴水中提取溴,有机层从分液漏斗的上口倒出
B.实验室可以用浓氨水和生石灰制备NH3
C.实验室中用加热方法分离碘和食盐的混合物
D.加入适量的NaOH可除去NaHCO3溶液中混有的少量Na2CO3
难度: 简单查看答案及解析
-
物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度有关。下列各组物质由于浓度不同而能发生不同氧化还原反应的是
①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Zn与H2SO4溶液 ④Fe与HCl溶液
A.①③ B.③④ C.①② D.①③④
难度: 简单查看答案及解析
-
对下列实验操作和事实的解释正确的是
A.某学生用pH试纸测新制氯水的pH值,先变红后褪色,是因为Cl2有强氧化性
B.向氯水中加入碳酸氢钠粉末,有气泡产生,说明氯水中含有H+
C.配制一定物质的量浓度的溶液发现浓度偏低,可能由于配制溶液所用的容量瓶事先未干燥
D.将铜片放入浓硫酸中,无明显实验现象,说明铜在冷的浓硫酸中发生钝化
难度: 简单查看答案及解析
-
用NA代表阿伏加德罗常数的值,下列叙述正确的是
A.11.2LCO和N2混合气体中含有的分子数是0.5NA
B.在铁参与的反应中,5.6g铁完全反应失去的电子数一定为0.3NA
C.1molNa2O和1molNa2O2中,含阴离子的数目均为NA
D.常温下,pH=12的1L氨水中含有的NH3·H2O分子数是0.01NA
难度: 中等查看答案及解析
-
下列说法正确的是
A.阳离子只有氧化性,阴离子只有还原性
B.失电子难的原子获得电子的能力一定强
C.得到电子越多的氧化剂,其氧化性就越强
D.要实现Fe2+→Fe3+的转化,必须加入氧化剂
难度: 简单查看答案及解析
-
在透明的酸性溶液中,能够大量共存的离子组是
A.Na+、K+、MnO
、SO
B.K+、NH
、NO
、I
C.Mg2+、K+、CO
、NO
D.Fe3+、Ag+、NO
、Cl
难度: 中等查看答案及解析
-
下列实验过程中,始终无明显现象的是
A.NH3通人AlCl3溶液中
B.用脱脂棉包裹Na2O2粉末露置在潮湿空气中
C.CO2通入CaCl2溶液中
D.稀盐酸滴加到Fe(OH) 3胶体溶液中
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是
A.钠与CuSO4溶液反应:2Na+Cu2+==2Na++Cu
B.钠加入水中:Na+2H2O==Na++2OH
+H2↑
C.碳酸氢钠溶液中加入足量氢氧化钠溶液:HCO
+OH
==CO
+H2O
D.漂白粉在空气中失效:ClO
十H2O+CO2==HCO
+HClO
难度: 中等查看答案及解析
-
下列过程不涉及氧化还原反应的是
A.二氧化氮气体冷却后颜色变浅 B.镁条在二氧化碳气体中燃烧
C.人工固氮 D.久置的浓硝酸显黄色
难度: 简单查看答案及解析
-
甲、乙、丙、丁四种物质之间存在如图所示转化关系,且甲、乙、丙均含有相同的某种元素。下列推断错误的是
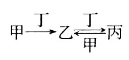
A.若丙为CO2,则甲可以是焦炭
B.若丁为O2,则甲可以是N2
C.若丁为Fe,则甲可以是Cl2
D.若丁为CO2,则甲可以是NaOH溶液
难度: 中等查看答案及解析
-
根据表中信息判断,下列选项不正确的是

A.第①组反应中,H2O2作还原剂
B.第②组反应中, Cl2与FeBr2的物质的量之比为3:2
C.第③组反应中,每生成1molCl2转移电子2mol
D.从三个反应可以得出:氧化性由强到弱顺序为MnO
Fe3+>Cl2>Br2
难度: 中等查看答案及解析
-
海洋中有丰富的食品、矿产、能源和药物。下图是从海水中提取某些原料的流程图。
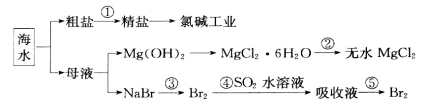
下列有关说法正确的是
A.从海水中提取物质都必须通过化学反应才能实现
B.第②步属于物理变化
C.从第④~⑤步的目的是浓缩、富集溴单质
D.第①步中除去粗盐中的SO
、Ca2+、Mg2+、Fe3+等杂质,加入试剂的顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
第Ⅱ卷(非选择题,共55分)
难度: 中等查看答案及解析