-
下列推断正确的是
A.SiO2 是酸性氧化物,能与NaOH溶液反应
B.Na2O、Na2O2组成元素相同,与 CO2反应产物也相同
C.CO、NO、 NO2都是大气污染气体,在空气中都能稳定存在
D.新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色
难度: 简单查看答案及解析
-
下列反应所得溶液中一定只含有一种溶质的是
A.向稀硝酸中加入铁粉
B.向稀盐酸中滴入少量的NaAlO2溶液
C.向NaOH溶液中通入CO2气体
D.向MgSO4、H2SO4的混合溶液中加入过量的Ba(OH) 2溶液
难度: 中等查看答案及解析
-
除去下列物质中少量杂质的方法正确的是
A.除去CO2中混有的HCl:用饱和碳酸钠溶液洗气
B.除去NO2中混有的NO:用水洗气
C.除去FeCl2溶液中混有的FeCl3:加入过量铁粉,过滤
D.除去Cu粉中混有的CuO:加适量稀硝酸后,过滤、洗涤
难度: 简单查看答案及解析
-
“5.12汶川大地震”后,消毒尤为重要,其中常用的消毒剂为“84”消毒液,其商品标识上有如下叙述: ①本品为无色溶液,呈碱性②使用时加水稀释 ③可对餐具、衣物进行消毒,可漂白浅色衣服。则其有效成份可能是
A、Cl2 B、SO2 C、NaClO D、KMnO4
难度: 中等查看答案及解析
-
下列有关铁元素的叙述中正确的是
A.铁是较活泼的金属,它与卤素(X2)反应的生成物均为FeX3
B.氢氧化铁可以由相应的物质通过化合反应而制得
C.氢氧化铁与氢碘酸反应:Fe(OH)3+3HI===FeI3+3H2O
D.铁元素位于周期表中第4周期ⅧB族
难度: 中等查看答案及解析
-
实验是研究化学的基础,下图中所示的实验方法、装置或操作完全正确的是
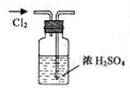
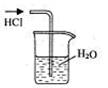
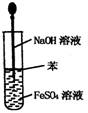
A.干燥Cl2 B.吸收HCl C.制取Fe(OH)2沉淀 D.稀释浓H2SO4
难度: 中等查看答案及解析
-
下列物质:①氢氟酸;②浓H2SO4;③烧碱溶液;④Na2CO3固体;⑤氧化钙;⑥浓HNO3,其中在一定条件下能与SiO2反应的有
A.①②⑥ B.全部 C.①③④⑤ D.②③⑥
难度: 中等查看答案及解析
-
青海昆仑玉被定为2008年北京奥运会奖牌用玉,昆仑玉主要成分是由“透闪石”和“阳起石”组成的纤维状微晶结合体,透闪石(Tremolite)的化学成分为Ca2Mg5Si8O22(OH)2.下列有关说法不正确的是
A.透闪石的化学式写成氧化物的形式为:2CaO·5MgO·8SiO2·H2O
B.透闪石中Mg元素的质量分数是Ca元素质量分数的1.5倍
C.1 mol Ca2Mg5Si8O22(OH)2与足量的盐酸作用,至少需要14 mol HCl
D.透闪石是一种新型无机非金属材料,难溶于水
难度: 中等查看答案及解析
-
制造太阳能电池需要高纯度的硅,工业上制高纯硅常用以下反应实现:
①Si(s)+3HCl(g)
SiHCl3(g)+H2(g);ΔH=-381 kJ·mol-1
②SiHCl3+H2
Si+3HCl 对上述两个反应的叙述中,错误的是
A.两个反应都是置换反应 B.反应②是吸热反应
C.两个反应互为可逆反应 D.两个反应都是氧化还原反应
难度: 中等查看答案及解析
-
已知还原性Cl-<Fe2+<H2O2<I-<SO2,判断下列反应不能发生的是
A.2Fe3++SO2+2H2O=SO42-+4H++2Fe2+ B.I2+SO2+2H2O=H2SO4+2HI
C.H2O2+2H++SO42-=SO2+O2+2H2O D.2Fe3++2I-=2Fe2++I2
难度: 中等查看答案及解析
-
下列各组单质中,前者在一定的条件下能将后者从其化合物中置换出来的是
①Al、Fe ②Cl2、S ③Mg、C ④H2、Cu ⑤C、Si
A.只有①③ B.只有②④ C.只有①②③④ D.①②③④⑤
难度: 中等查看答案及解析
-
下列各组中的两种物质相互反应时,无论哪种过量,都可以用同一个离子方程式表示的是
①碳酸钠溶液与盐酸 ②硫化氢气体与氯化铁溶液
③硫酸铝溶液与氨水 ④硝酸银溶液与氨水
⑤溴化亚铁溶液与氯水 ⑥碳酸氢钙溶液与澄清石灰水
A.③⑤ B.①③⑥ C.②④ D.②③⑥
难度: 中等查看答案及解析
-
在含有Cu(NO3)2、Zn(NO3)2、Fe(NO3)3、AgNO3各0.1mol的混合溶液中加入 0.1mol铁粉,充分搅拌后铁完全反应,溶液中不存在Fe3+,同时析出0.1molAg。则下列结论中不确的是
A.反应后溶液中Cu2+与Fe2+的物质的量之比为1:2 B.氧化性:Ag+>Cu2+>Fe3+>Zn2+
C.含Fe3+的溶液可腐蚀铜板 D.1molFe可还原2molFe3+
难度: 中等查看答案及解析
-
在给定的溶液中,加入对应的一组离子,则该组离子能在原溶液中大量共存的是
A.滴加甲基橙显红色的溶液:I-、NH4+、Cl-、NO3-
B.含有大量AlO2-的溶液:Na+、K+、NO3-、CO32-
C.常温下由水电离出来的c(H+)=10-13 mol/L的溶液: K+、HCO3-、Br-、Ba2+
D.含有溶质为NaHSO4的溶液: K+、SiO32-、NO3-、Al3+
难度: 中等查看答案及解析
-
下列各组溶液中,用括号内的试剂及物质间相互反应不能鉴别的一组是
A.Ba(OH) 2 KSCN NaCl Mg(NO3)2 (FeCl3溶液)
B.NaNO3 NaHCO3 (NH4)2SO3 Na2SiO3 (H2SO4溶液)
C.NH4Br K2CO3 NaI CaCl2 (AgNO3溶液)
D.(NH4) 3PO4 NaBr CuSO4 AlCl3 (KOH溶液)
难度: 中等查看答案及解析
-
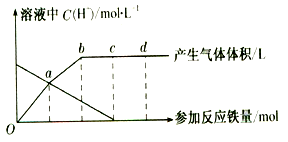
取10 mL 0.4 mol·L-1 FeCl3溶液置于烧杯中,向其中加入一定量的Fe、Cu混合物充分反应。下列叙述中一定不正确的是(设溶液体积不变,不考虑水解因素)
A.烧杯中有Cu无Fe,反应后溶液中c(Fe2+)≤0.6 mol·L-1
B.烧杯中有Fe无Cu,反应后溶液中c(Fe2+)=0.6 mol·L-1
C.烧杯中Fe、Cu均无,反应后溶液中c(Cl-)=1.2 mol·L-1
D.烧杯中Fe、Cu均有,反应后溶液中c(Fe2+)=0.6 mol·L-1
难度: 中等查看答案及解析
-
下列离子方程式的书写正确的是
A.四氧化三铁和过量的稀硝酸反应:Fe3O4 + 8H+ =4H 2O + Fe 2+ + 2Fe 3+
B.NaHCO3溶液与NaOH溶液反应: OH- + HCO3- = CO2↑+ H2O
C.氯气溶于水 Cl2+H2O
2H++Cl-+ClO-
D.Ca(HCO3)2溶液与任意量澄清Ca(OH)2溶液反应:Ca2+ + HCO3 -+ OH-=CaCO3↓+H2O
难度: 中等查看答案及解析
-
将3.9g镁铝合金,投入到500mL2mol·L-1的盐酸中,金属完全溶解,再加入4mol·L-1
的NaOH溶液,若要生成的沉淀最多,加入的这种NaOH溶液的体积是
A.125mL B.200mL C.250mL D. 560mL
难度: 中等查看答案及解析