-
下列说法正确的是:( )
A.信息产业中的光缆的主要成份是单质硅
B.高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强
C.NOx、CO2、PM2.5颗粒都会导致酸雨
D.煤经气化、液化和干馏三个物理变化过程,可变为清洁能源
难度: 简单查看答案及解析
-
在室温下,下列各组微粒在溶液中能大量共存的是( )
A.Na+、Ba2+、OH-、Cl- B.H+、Fe2+、ClO-、SO42-
C.K+、Fe3+、C6H5O-、SCN- D.NH4+、Al3+、SiO32-、CO32-
难度: 中等查看答案及解析
-
以NA表示阿佛加德罗常数,下列说法中正确的是:( )
A.标准状况下,22.4L苯含有NA个苯分子
B.0.2 mol·L-1 FeCl3溶液中含有Cl-总数为0.6NA
C.在标准状况下,含4molHCl的浓盐酸与足量的MnO2反应可生成22.4L氯气
D.4g氦气所含分子数为NA
难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A.铁溶于足量的稀硝酸,溶液变黄:3Fe+8H++2NO3-= 3Fe2++2NO↑+4H2O
B.NaHSO4溶液与NaOH溶液混合:OH-+H+= H2O
C.NH4HCO3溶液与足量KOH浓溶液共热:NH4++OH-
NH3↑+H2O
D.Fe2O3溶于足量的氢碘酸溶液中:Fe2O3+6H+=2Fe3++3H2O
难度: 中等查看答案及解析
-
下列物质的用途中,利用物质氧化性的是( )
A.SO2漂白织物 B.用热的纯碱溶液清洗油污
C.食醋清洗水垢 D.次氯酸消毒餐具
难度: 中等查看答案及解析
-
元素周期表和元素周期律可以指导人们进行规律性的推测和判断。下列说法不合理的是( )
A.若X+和Y2-的核外电子层结构相同,则原子序数:X > Y
B.由水溶液的酸性:HCl>H2S,可推断出元素的非金属性:Cl>S
C.硅、锗都位于金属与非金属的交界处,都可以做半导体材料
D.Cs和Ba分别位于第六周期IA和IIA族,碱性:CsOH >Ba(OH)2
难度: 中等查看答案及解析
-
下列根据实验操作和现象所得出的结论正确的是( )
选项 实验操作 实验现象 结论
A 向两份蛋白质溶液中分别滴加饱和NaCl 溶液和CuSO4 溶液 均有固体析出 蛋白质均发生变性
B 向溶液X 中先滴加稀硝酸,再滴加Ba(NO3)2溶液 出现白色沉淀 溶液X 中一定含有SO42-
C 用大理石和盐酸反应制取CO2 气体,立即通入一定浓度的Na2SiO3 溶液中 出现白色沉淀 H2CO3的酸性比H2SiO3的酸性强
D 向浓度均为0. 1 mol·L-1 NaCl 和NaI 混合溶液中滴加少量AgNO3 溶液 出现黄色沉淀 Ksp(AgCl)>Ksp(AgI)
难度: 中等查看答案及解析
-
下列陈述Ⅰ、Ⅱ正确并且有因果关系的是 ( )
选项 陈述Ⅰ 陈述Ⅱ
A H2O2、SO2都能使酸性高锰酸钾褪色 前者表现出还原性后者表现出漂白性
B 纯银器表面在空气中渐渐变暗 发生了化学腐蚀
C SiO2能与氢氟酸及碱反应 SiO2是两性氧化物
D 反应物比例不同可导致产物不同 Na与O2反应可能生成Na2O,也可能生成Na2O2
难度: 中等查看答案及解析
-
CO(g)+H2O(g)
H2(g)+CO2(g)△H﹤0,在其他条件不变的情况下,说法正确的是 ( )
A.加入催化剂,改变了反应的途径,反应的△H也随之改变
B.改变压强,平衡不发生移动,反应放出的热量不变
C.升高温度,反应速率加快,反应放出的热量不变
D.若在原电池中进行,反应放出的热量不变
难度: 中等查看答案及解析
-
下列有关海水综合利用的说法正确的是( )
A.海水中含有钾元素,只需经过物理变化就可以得到钾单质
B.电解MgCl2饱和溶液,可制得金属镁
C.从海水中可以得到NaCl,电解熔融NaCl可制得金属钠
D.从海带中提取碘单质的过程不涉及氧化还原反应
难度: 中等查看答案及解析
-
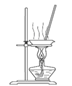
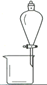
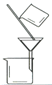
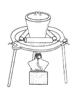
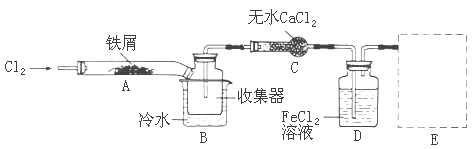
用下列实验装置进行相应的实验,能达到实验目的的是( )

A.图I用于实验室制氨气并收集干燥的氨气
B.图II用于除去CO2中含有的少量HCl
C.图III用于提取I2的CCl4溶液中的I2
D.图IV用于检查碱式滴定管是否漏液
难度: 中等查看答案及解析
-
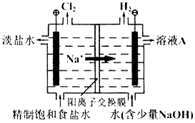
“天宫一号”飞行器白天靠太阳能帆板产生电流向镍氢电池充电,夜间镍氢电池向飞行器供电。镍氢电池结构示意图如图。若电池总反应为:Ni(OH)2
NiO(OH)+1/2H2,充电时阴极反应为:H2O+e-=1/2H2+OH-。则下列说法正确的是( )
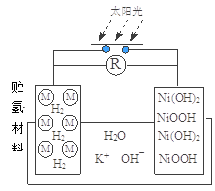
A.充电时a极为正极
B.放电时NiO(OH)发生氧化反应
C.充电时,K+移向a极,OH-移向b极
D.放电时正极反应为:NiO(OH) + H2O +e- = Ni(OH)2 + OH-
难度: 中等查看答案及解析
-
下图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图。
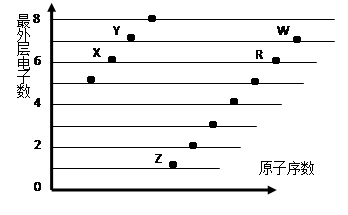
下列说法正确的是( )
A.X和R在同一周期
B.原子半径:W>R>X
C.气态氢化物的稳定性:Y>X
D.X、Z形成的化合物中可能含有共价键
难度: 中等查看答案及解析
-
在密闭容器中存在如下反应:2SO2(g)+O2(g)
2SO3(g) ΔH<0,某研究小组研究其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( )
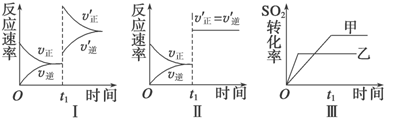
A.图Ⅰ表示的是t1时刻增大压强对反应速率的影响
B.图Ⅱ表示的是t1时刻加入催化剂后对反应速率的影响
C.图Ⅲ表示的是催化剂对平衡的影响,且甲的催化效率比乙高
D.图Ⅲ表示的是压强对化学平衡的影响,且乙的压强较高
难度: 困难查看答案及解析