-
化学与人类社会的生产、生活有着密切联系。下列叙述中正确的是
A.苹果放在空气中久置变黄和纸张久置变黄原理相似
B.用活性炭为蔗糖脱色和用臭氧漂白纸浆,原理相似
C.钢铁制品和铜制品既能发生吸氧腐蚀又能发生析氢腐蚀
D.黄河入海口沙洲的形成与用卤水点豆腐,都体现了胶体聚沉的性质
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.1 molCl2与足量Fe反应转移电子数一定为3NA
B.1mol SiO2晶体中含NA个SiO2分子
C.1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3 NA
D.标准状况下,22.4L氨水含有NA个NH3分子
难度: 中等查看答案及解析
-
短周期元素W、X、Y、Z在元素周期表中的位置如图所示,其中W的单质是空气的主要成分,化学性质稳定,不易参加化学反应,则下列有关说法中错误的是

A.W和Y可以形成稳定的化合物,耐热性好,是新型陶瓷材料
B.Z元素的最高价氧化物水化物的酸性强于Y
C.四种元素常见的氢化物,一定是Y元素形成的氢化物最不稳定
D.向氢化物WH3与HZ反应后的集气瓶中加入足量的水,所得溶液一定呈酸性
难度: 困难查看答案及解析
-
近几年科学家发明的一种新型可控电池——锂水电池,工作原理如图所示。下列有关说法不正确的是
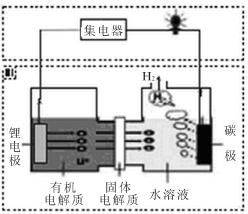
A.碳极发生的反应是:2H2O+2e-=H2↑+2OH-
B.有机电解质和水溶液不可以互换区域
C.标况下产生22.4L的氢气时,正极消耗锂的质量为14g
D.该装置不仅可提供电能,还可得到清洁的氢气
难度: 困难查看答案及解析
-
已知酸性:H2SO4>
>H2CO3>
>HCO3—,综合考虑反应物的转化率和原料成本等因素,将
转变为
的最佳方法是
A.与足量的NaOH溶液共热后,再通入足量CO2
B.与足量的NaOH溶液共热后,再加入适量H2SO4
C.与稀H2SO4共热后,加入足量的NaOH溶液
D.与稀H2SO4共热后,加入足量的Na2CO3溶液
难度: 困难查看答案及解析
-
下列实验装置正确且能完成实验目的的是

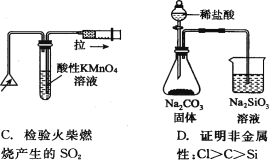
难度: 中等查看答案及解析
-
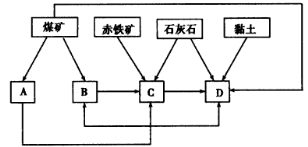
还原沉淀法是处理含铬(含Cr2O72-和CrO42-)工业废水的常用方法,过程如下:
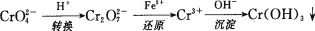
已知转化过程中的反应为2CrO42-(aq)+2H+(aq)
Cr2O72-(aq)+H2O(l)。转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有10/11转化为Cr2O72-,下列说法不正确的是
A.溶液颜色保持不变,说明上述可逆反应达到平衡状态
B.若用绿矾(FeSO4·7H2O)作还原剂,处理1L废水,至少需要458.7g
C.常温下转化反应的平衡常数K=1×1014,则转化后所得溶液的pH=5
D.常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中的c(Cr3+)降至1×10-5mol/L,应调溶液的pH=5
难度: 极难查看答案及解析
-
【化学——选修3:物质结构与性质】(15分)有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30)。A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E原子最外层有1个单电子,其次外层有3个能级且均排满电子;D与E同周期,价电子数为2。则:
(1)D的元素符号为______。A的单质分子中π键的个数为______。
(2)B元素的氢化物的沸点是同族元素氢化物中最高的,原因是___________________。
(3)A、B、C 3种元素的第一电离能由大到小的顺序为________(用元素符号表示)。
(4)写出基态E原子的价电子排布式:__________________。
(5)A的最简单氢化物分子的空间构型为________,其中A原子的杂化类型是________。
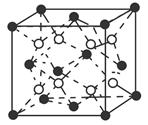
(6)C和D形成的化合物的晶胞结构如图所示,已知晶体的密度为ρ g·cm-3,阿伏加德罗常数为NA,求晶胞边长a=________cm。(用ρ、NA的计算式表示)
难度: 困难查看答案及解析