-
元素周期表和元素周期律可以指导人们进行规律性的推测和判断.下列说法不合理的是( )
A. 若X+和Y2﹣的核外电子层结构相同,则原子序数:X>Y
B. 元素周期表中位于金属和非金属分界线附近能找到半导体的元素
C. Cs和Ba分别位于第六周期IA和IIA族,碱性:CsOH>Ba(OH)2
D. 由水溶液的酸性:HCl>H2S,可推断出元素的非金属性:Cl>S
难度: 简单查看答案及解析
-
卫生部发出公告,自2011年5月1日起,禁止在面粉生产中添加过氧化钙(CaO2)等食品添加剂.下列对于过氧化钙(CaO2)的叙述错误的是( )
A.CaO2具有氧化性,对面粉可能具有增白作用
B.CaO2中阴阳离子的个数比为1:1
C.CaO2和水反应时,每产生1mol O2转移电子4mol
D.CaO2和CO2反应的化学方程式为:2CaO2+2CO2=2CaCO3+O2
难度: 简单查看答案及解析
-
根据原子结构及元素周期律的知识,下列叙述正确的是( )
A. 由于分子中氢原子数:H2SO4>HClO4,故酸性:H2SO4>HClO4
B. 硅处于金属与非金属的过渡位置,硅可用作半导体材料
C. 由于氮元素的最低化合价只有﹣3价,故NH5这种物质不可能存在
D. Cl﹣、S2﹣、Ca2+、K+半径逐渐减小
难度: 简单查看答案及解析
-
NA表示阿伏加罗常数的值,下列说法正确的是( )
A.2.4g Mg在足量O2中燃烧,转移的电子数为0.1NA
B.标准状况下,5.6L CO2气体中含有的氧原子数为0.5NA
C.氢原子数为0.4NA的CH3OH分子中含有的σ键数为0.4NA
D.0.1L0.5mol/L CH3COOH溶液中含有的H+数为0.05NA
难度: 简单查看答案及解析
-
下列说法中错误的是( )
A.干冰与二氧化硅晶体熔化时,所克服的微粒间相互作用不相同
B.白磷(P4)分子是正四面体结构,故分子中的键角为1090281
C.CsCl晶体中每个Cs+周围紧邻的Cl﹣和每个Cl﹣周围紧邻的Cs+个数相等
D.晶格能由大到小:NaF>NaCl>NaBr>NaI
难度: 简单查看答案及解析
-
“类推”是一种重要的学习方法,但有时会产生错误,下列类推结论正确的是( )
A. 第2周期元素氢化物的稳定性顺序是:HF>H2O>NH3;则第3周期元素氢化物的稳定性顺序也是:HCl>H2S>PH3
B. ⅣA族元素氢化物沸点顺序是:GeH4>SiH4>CH4;则ⅤA族元素氢化物沸点顺序也是:AsH3>PH3>NH3
C. 晶体中有阴离子,必有阳离子;则晶体中有阳离子,必有阴离子
D. 干冰(CO2)是分子晶体,则SiO2也是分子晶体
难度: 中等查看答案及解析
-
原子序数依次增大的X、Y、Z、M、W五种短周期元素,其中X是周期表中原子半径最小的元素,Y、Z同周期,X、M同主族;X、Y、W的最外层电子数之和为12;Z的单质为空气中含量最高的成分,W的最高价和最低价代数和为6.下列说法中正确的是( )
A. 根据价层电子对互斥理论知化合物ZX3的空间构型为三角锥形
B. Y的电负性比Z的电负性强
C. W的氧化物对应的水化物一定是强酸
D. 原子半径:W>M>Z>Y
难度: 简单查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.加入铝粉产生H2 的溶液中:Fe2+、Na+、SO2﹣4、ClO﹣
B.由水电离的c(H+)=1×10﹣14mol•L﹣1的溶液中:Ca2+、K+、Cl﹣、HCO﹣3
C.
 =1012的溶液中:NH+4、Al3+、NO﹣3、Cl﹣
=1012的溶液中:NH+4、Al3+、NO﹣3、Cl﹣D.使甲基橙呈红色的溶液:K+、Cl﹣、SO2﹣4、S2O32﹣
难度: 简单查看答案及解析
-
下列有关物质结构的说法正确的是( )
A. 电子层数多的原子的半径一定大于电子层数少的原子的半径
B. P4S3分子中各原子的最外层均已达到了8电子稳定结构,则分子中共价键数目为9条
C. H2SO3酸性强于H2CO3,所以非金属性S大于C
D. 不同原子形成的化合物中一定只含极性键
难度: 简单查看答案及解析
-
下列指定反应的离子方程式正确的是( )
A.将铜插入稀硝酸中:Cu+4H++2NO3﹣═Cu2++2NO2↑+H2O
B.向Fe2(SO4)3溶液中加入过量铁粉:Fe3++Fe═2Fe2+
C.向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+
D.向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+3H+═H2SiO3↓+3Na+
难度: 简单查看答案及解析
-
近年来,科学家合成了一系列具有独特化学特性的氢铝化合物(AlH3)n.已知,最简单的氢铝化合物的分子式为Al2H6,它的熔点为150℃,燃烧热极高.Al2H6球棍模型如图.下列有关说法肯定错误的是( )
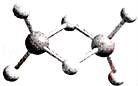
A.Al2H6在固态时所形成的晶体是分子晶体
B.氢铝化合物可能成为未来的储氢材料和火箭燃料
C.Al2H6中含有离子键和极性共价键
D.Al2H6在空气中完全燃烧,产物为氧化铝和水
难度: 简单查看答案及解析
-
选项
实验操作
现象
结论
A
将某溶液与稀盐酸反应产生的气体通入澄清石灰水
石灰水变浑浊
该溶液中一定含有CO32﹣
B
常温下,将铁片浸入足量浓硫酸中
铁片不溶解
常温下,铁与浓硫酸 一定没有发生化学反应
C
向某食盐溶液中滴加淀粉溶液
溶液颜色不变
不能说明该食盐中一定没有添加碘化钾
D
向盛有25mL沸水的烧杯中滴加5﹣6滴FeCl3饱和溶液,继续煮沸
溶液生成红褐色沉淀
制得Fe(OH)3胶体
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
下列关于晶体的叙述中,不正确的是…( )
A.金刚石网状结构中,由共价键形成的碳原子环其中最小环有6个碳原子
B.在氯化钠的晶体中,每个Na+或Cl﹣的周围都紧邻6个Cl﹣或Na+
C.在氯化铯晶体中,每个Cs+周围都紧邻8个Cl﹣,每个Cl﹣周围也紧邻8个Cs+
D.在干冰的晶体中,每个CO2分子周围都紧邻4个CO2分子
难度: 简单查看答案及解析
-
选项
实验
现象
结论
A
SO2通入BaCl2溶液,然后滴入稀硝酸
产生白色沉淀,加入稀硝酸沉淀不溶解
开始的沉淀为BaSO3,后来转化为BaSO4
B
KBrO3溶液中加入少量苯,然后通入少量Cl2振荡
静止后有机相呈橙色
氧化性:Cl2>Br2
C
向足量含淀粉的FeI2溶液中滴加2滴氯水
溶液变蓝
还原性:I﹣>Fe2+
D
将重晶石浸泡在饱和碳酸钠溶液中
一段时间后固体溶解
Ksp(BaCO3)<Ksp(BaSO4)
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
S2Cl2是广泛用于橡胶工业的硫化剂;其分子结构如图所示.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体.下列说法中错误的是( )

A.S2Cl2的电子式为
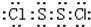
B.S2Cl2为含有极性键和非极性键的非极性分子
C.S2Br2与S2Cl2结构相似,熔沸点:S2Br2>S2Cl2
D.S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O═SO2↑+3S↓+4HCl
难度: 简单查看答案及解析
-
某同学利用下列实验探究金属铝与铜盐溶液反应:下列说法正确的是( )

A.由实验1 可以得出结论:金属铝的活泼性弱于金属铜
B.实验2 中生成红色物质的离子方程式:Al+Cu2+═Al3++Cu
C.溶液中阴离子种类不同是导致实验1、2 出现不同现象的原因
D.由上述实验可推知:用砂纸打磨后的铝片分别与浓度均为0.2mol•L﹣1的盐酸和硫酸反应,后者更剧烈
难度: 简单查看答案及解析
-
五种短周期主族元素A、B、C、D、E的原子序数依次递增,A2属于绿色燃料,C的氧化物常用于玻璃的生产,D元素原子的核电荷数是同主族上一周期元素的2倍,B、C为同周期元素,B、D原子最外层电子数之和等于E的最外层电子数. 根据以上叙述,下列说法中正确的是( )
A. 五种元素中B元素的金属性最强
B. 元素D、E分别与元素A形成化合物的稳定性:A2D>AE
C. 元素C、D、E的最高价氧化物对应水化物的酸性递减
D. 元素B、D、E的简单离子半径大小为:B>D>E
难度: 简单查看答案及解析
-
某白色粉末由两种物质组成,为鉴别其成分进行如下实验:
①取少量样品加入足量水仍有部分固体未溶【解析】
再加入足量稀盐酸,有气泡产生,固体全部溶解;②取少量样品加入足量稀硫酸有气泡产生,震荡后仍有固体存在.
该白色粉末可能为( )
A.NaHCO3、Al(OH)3 B.AgCl、NaHCO3 C.Na2SO3、BaCO3 D.Na2CO3、CuSO4
难度: 简单查看答案及解析
-
已知电离平衡常数:H2CO3>HClO>HCO3﹣,氧化性:HClO>Cl2>Br2>Fe3+>I2.下列有关离子反应或离子方程式的叙述中,正确的是( )
A.向0.1molFeI2溶液中滴加少量氯水,反应中有0.3NA电子转移
B.向溴水中加入足量氯化亚铁能使溶液变成无色
C.向NaClO溶液中通入少量CO2的离子方程式:2ClO﹣+CO2+H2O═2HClO+CO32﹣
D.能使pH试纸显深红色的溶液,Fe3+、Cl﹣、Ba2+、Br﹣能大量共存
难度: 困难查看答案及解析
-
某试液中只可能含有K+、NH4+、Fe2+、Al3+、Cl﹣、SO42﹣、CO32﹣、AlO2﹣ 中的若干种离子,离子浓度均为0.1mol•L﹣1.某同学进行了如下实验:
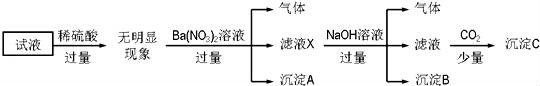
下列说法正确的是( )
A.无法确定原试液中是否含有Al3+、Cl﹣
B.滤液X中大量存在的阳离子有NH4+、Fe2+和Ba2+
C.无法确定沉淀C的成分
D.原溶液中存在的离子为NH4+、Fe2+、Cl﹣、SO42﹣
难度: 困难查看答案及解析