-
化学与生活、生产、环境等社会实际密切相关。下列叙述正确的是( )
A.稀的食盐水能杀死H7N9禽流感病毒
B.涤纶、塑料、光导纤维都是有机高分子材料
C.用电镀厂的废水直接灌溉农田,可提高水的利用率
D.外形似海绵、密度小、有磁性的碳与石墨互为同素异形体
难度: 中等查看答案及解析
-
下列有关化学用语表示正确的是( )
A.甲基的电子式:
B.镁离子的结构示意图:
C.质量数为34、中子数为18的核素:
S
D.乙酸的结构简式:
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A. c(H+)/c(OH-)=1×1014的溶液:Fe2+、K+、HSO
、ClO-
B. 0.1 mol·L-1FeCl3溶液:NH
、H+、I-、SCN-
C. 0.1 mol·L-1Na2CO3溶液:K+、Ca2+、HCO
、SO
D. 使酚酞变红色的溶液:Na+、Ba2+、NO
、Cl-
难度: 中等查看答案及解析
-
下列有关物质性质和应用都正确的是( )
A. 氢氟酸具有强酸性,可用于雕刻玻璃
B. 氨气显碱性,可用P2O5或无水CaCl2干燥
C. MgO、Al2O3熔点高,它们都可用于制作耐火材料
D. 铜的活动性比铁弱,可在海轮外壳装铜块减缓海轮腐蚀
难度: 中等查看答案及解析
-
用下列装置进行相应实验,不能达到实验目的的是( )
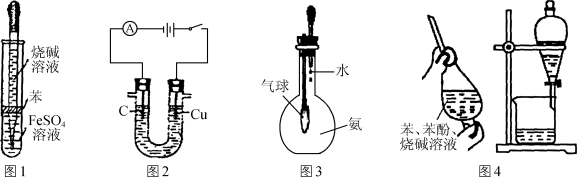
A. 图1所示装置可制备氢氧化亚铁
B. 图2所示装置可电解食盐水制氯气和氢气
C. 图3所示装置可验证氨气极易溶于水
D. 图4所示装置与操作可除去苯中的苯酚
难度: 中等查看答案及解析
-
甲、乙、丙、丁均为中学化学中常见的单质或化合物,它们之间的转化关系如下图所示(部分产物已略去),下列各组物质中不能按图示关系转化的是( )
选项
甲
乙
丙
丁
A
NaOH
NaHSO3
Na2SO3
SO2
B
AlCl3
NaAlO2
Al(OH)3
NaOH
C
Fe
Fe(NO3)3
Fe(NO3)2
HNO3
D
C
CO
CO2
O2
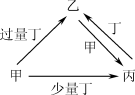
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 25 ℃,pH=13的NaOH溶液中,含有OH-的数目为0.1NA
B. 1.2 g C60和石墨的混合物中,含有的碳原子数目为0.1NA
C. 2.24 L N2和NH3的混合气体中,含有的共用电子对数目为0.3NA
D. 标准状况下,6.72 L NO2与水充分反应转移的电子数目为0.1NA
难度: 中等查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是( )
A. 明矾溶液中滴加过量氨水:Al3++3NH3·H2O===Al(OH)3↓+3NH
B. 醋酸溶液与Mg(OH)2反应:Mg(OH)2+2H+===Mg2++2H2O
C. 小苏打溶液中加足量澄清石灰水:2HCO
+Ca2++2OH-===CaCO3↓+2H2O+CO
D. SO2通入FeCl3溶液中:SO2+Fe3++2H2O===SO
+Fe2++4H+
难度: 中等查看答案及解析
-
高铁电池是一种新型可充电电池,电解质溶液为KOH溶液,放电时的总反应式为3Zn+2K2FeO4+8H2O===3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述正确的是( )
A. 放电时,负极反应式为3Zn-6e-+6OH-===3Zn(OH)2
B. 放电时,正极区溶液的pH减小
C. 充电时,每转移3 mol电子,阳极有1 mol Fe(OH)3被还原
D. 充电时,电池的锌电极接电源的正极
难度: 中等查看答案及解析
-
短周期主族元素A、B、C、D、E的原子序数依次递增,A的单质在常温下呈气态,D元素的单质既能与盐酸反应也能与NaOH溶液反应,B、C、E原子的最外层电子数之和为13,E原子的最外层电子数是B原子内层电子数的3倍或是C原子最外层电子数的3倍。下列说法正确的是( )
A. 原子半径的大小顺序:r(B)>r(C)>r(A)
B. 元素E的氧化物的水化物一定是强酸
C. D单质在一定条件下可以与氧化铁发生置换反应
D. 工业上常用电解元素C、D的氯化物来制取它们的单质
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 在氨水中加入少量的水或氯化铵固体后,都能使溶液中的c(OH-)减小
B. 反应Hg(l)+H2SO4(aq)===HgSO4(aq)+H2(g)在常温下不能自发进行,则ΔH<0
C. 工业电解食盐水中,电解池被阳离子交换膜隔成阴极室和阳极室,目的是避免阳极产生的气体与烧碱反应
D. 在等浓度的NaCl和Na2CrO4稀溶液中滴加AgNO3溶液,先析出AgCl沉淀,则Ksp(AgCl)<Ksp(Ag2CrO4)
难度: 中等查看答案及解析
-
阿维A酯是一种皮肤病用药,可由原料X经过多步反应合成:
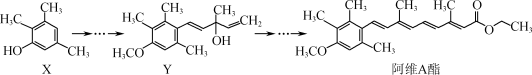
下列叙述正确的是( )
A. 有机物X与Y互为同系物
B. 有机物Y与阿维A酯均能与NaOH溶液反应
C. 一定条件下1 mol阿维A酯能与4 mol H2发生加成反应
D. X中有6种化学环境不同的氢原子,Y中有1个手性碳原子
难度: 中等查看答案及解析
-
只用下表提供的仪器、试剂,就能达到相应实验目的的是( )
选项
仪器
试剂
相应实验目的
A
托盘天平(带砝码)、滴管、量筒、烧杯、药匙、玻璃棒
食盐,蒸馏水
配制一定物质的量浓度的NaCl溶液
B
烧杯、漏斗、滴管、铁架台(带铁圈)、玻璃棒、滤纸、导气管
AlCl3溶液(含少量MgCl2),烧碱,CO2,稀盐酸
除去AlCl3溶液中少量的MgCl2
C
酸式滴定管、滴管、铁架台(带铁夹)
已知浓度的盐酸,未知浓度的NaOH溶液
测定NaOH溶液的浓度
D
分液漏斗、烧瓶、锥形瓶、导管、橡皮塞
稀盐酸,大理石,硅酸钠溶液
证明非金属性:Cl>C>Si
难度: 中等查看答案及解析
-
下列溶液中各离子的浓度关系不正确的是( )
A. 0.1 mol·L-1CH3COONa溶液中:c(CH3COO-)+c(CH3COOH)=0.1 mol·L-1
B. 浓度均为0.1 mol·L-1 Na2CO3溶液和稀盐酸等体积混合后的溶液中:
c(CO
)+c(OH-)=c(H+)+c(H2CO3)
C. 25 ℃时,pH=9.4、浓度均为0.1 mol·L-1的HCN与NaCN的混合溶液中:
c(Na+>c(CN-)>c(HCN)>c(OH-)
D. 3.0 L 0.1 mol·L-1 NaOH溶液中缓慢通入CO2至溶液增重8.8 g时,溶液中:
c(Na+)>c(CO
)>c(HCO
)>c(OH-)>c(H+)
难度: 中等查看答案及解析
-
向甲、乙两个容积均为1 L的恒温恒容的密闭容器中,分别充入一定量的SO2和O2(其中,甲充入2 mol SO2、1 mol O2,乙充入1 mol SO2、0.5 mol O2),发生反应:2SO2(g)+O2(g)
2SO3(g);ΔH=-197.74 kJ·mol-1。

一段时间后达到平衡,测得两容器中c(SO2)(mol·L-1)随时间t(min)的变化关系如右图所示。下列说法正确的是( )
A. 热量:Q(甲)<2Q(乙)
B. 压强:p(甲)<2p(乙)
C. 乙中前5 min内的反应速率v(O2)=0.10 mol·L-1·min-1
D. 保持其他条件不变,若起始时向乙中充入0.4 mol SO2、0.2 mol O2、0.4 mol SO3,则此时v(正)<v(逆)
难度: 中等查看答案及解析


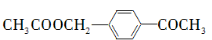 的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:

