-
下列有关说法不正确的是
A.服用铬含量超标的药用胶囊会对人对健康造成危害
B.光化学烟雾不会引起呼吸道疾病
C.“血液透析”利用了胶体的性质
D.大气中CO2含量的增加会导致温室效应加剧
难度: 简单查看答案及解析
-
NA为阿伏加德罗常数的数值,下列说法中正确的是
A.0.5molO3与11.2LO2所含的分子数一定相等
B.在密闭容器中加入1.5 mol H2和0.5 molN2,充分反应后可得到NH3分子数为NA
C.常温常压下,7.0g乙烯与丁烯的混合物中含有氢原子的数目为NA
D.标准状况下,22.4 L氯气与足量铁粉充分反应,转移的电子数为3 NA
难度: 简单查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.1.0 mol·L-1的KNO3溶液:H+、Fe2+、Cl-、SO42-
B.饱和氯水中 :NH4+、SO32-、AlO2-、Cl-
C.与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3-
D. c(H+)=1.0×10-13mol/L溶液中:K+、Na+、CH3COO-、Br-
难度: 简单查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是
A.用FeCl3溶液腐蚀铜线路板:Cu + 2Fe3+ = Cu2+ + 2Fe2+
B.AlCl3溶液中加入过量的浓氨水:Al3++4NH3·H2O = AlO2-+4NH4++2H2O
C.大理石溶于醋酸中的反应:CaCO3+2H+=Ca2++H2O+CO2↑
D.钠与水反应:Na + 2H2O = Na+ + 2OH- + H2↑
难度: 简单查看答案及解析
-
下列实验中,所选装置或实验设计合理的是
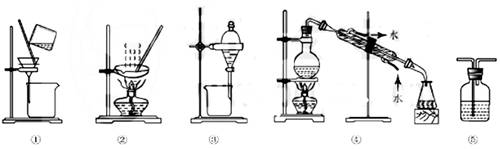
A. 图⑤ 所示装置中盛有饱和Na2SO3溶液除去SO2中含有的少量HCl
B. 用乙醇提取溴水中的溴选择图③所示装置
C. 用图①和② 所示装置进行粗盐提纯
D. 用图④所示装置进行石油分馏实验制取丁烯
难度: 简单查看答案及解析
-
宁夏的硒砂瓜现今已享誉区内外,西瓜富含硒元素,有延年益寿、抗衰老、抗癌作用,因之得名“硒砂瓜”。二氧化硒(Se)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。在回收过程当中涉及到如下两个化学反应①SeO2+4KI+4HNO3
Se+2I2+4KNO3+2H2O;
②Se+2H2SO4(浓)
2SO2↑+SeO2+2H2O
下列有关叙述正确的是
A.SeO2、H2SO4(浓)、I2的氧化性由强到弱的顺序是H2SO4(浓)> SeO2> I2。
B.①中Se是氧化产物,I2是还原产物
C.反应①中KI是氧化剂,SeO2是还原剂
D.反应①中每有0.6 mol I2生成,转移电子数目为2.4NA
难度: 简单查看答案及解析
-
某无色溶液中含有:①K+、②Ba2+、③Cl-、④Br-、⑤SO、⑥CO、⑦SO中的一种或几种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:
步骤
操作
现象
①
用pH试纸检验
溶液的pH大于7
②
向溶液中滴加氯水,再加入CCl4振荡,静置
CCl4层呈橙色
③
向②所得溶液中加入Ba(NO3)2溶液和稀HNO3
有白色沉淀产生
④
过滤,向滤液中加入AgNO3溶液和稀HNO3
有白色沉淀产生
下列结论正确的是( )
A.可能含有的离子是①②⑦ B.肯定没有的离子是②⑤⑥
C.不能确定的离子是①③⑦ D.肯定含有的离子是①④
难度: 简单查看答案及解析