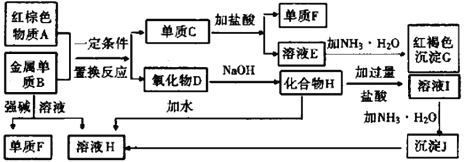
-
唐末五代时期丹学著作《真元妙道要略》中有云“以硫磺、雄黄合硝石并蜜烧之,焰起烧手面及烬屋舍者”。描述的是( )的制作过程
A.铝热剂 B.黑火药
C.木炭 D.丹药(硫化汞)
难度: 简单查看答案及解析
-
下列说法中正确的是( )
A. 失电子越多,还原性越强,得电子越多,氧化性越强
B. 2Fe3++Cu=2Fe2++Cu2+,此反应中氧化性:Cu>Fe2+
C. SO42-中的硫原子化合价是+6价,处于硫的最高价,因此SO42-氧化性一定很强
D. 氧化性强弱的顺序为;Z2>A3+,则溶液中可发生:Z2+2A2+=2A3++2Z-
难度: 简单查看答案及解析
-
下列有关叙述正确的是( )
A. 蒸馏实验中温度计的水银球应插入溶液中
B. 胶体带电荷,溶液不带电荷
C. 分液时,先打开玻璃塞,再打开旋塞,使下层液体从下口流出,上层液体从上口倒出
D. 加热铝箔,铝并不滴落,说明铝具有很高的熔点
难度: 简单查看答案及解析
-
下列关于某物质是否为电解质的判断正确的是( )
A. 固体氯化钠不导电,所以氯化钠不是电解质
B. 氯化氢水溶液能导电,所以盐酸是电解质
C. SO2溶于水能导电,但是SO2是非电解质
D. BaSO4不溶于水,所以BaSO4是非电解质
难度: 中等查看答案及解析
-
在配制溶液过程中正确的是( )
A. 配制盐酸溶液用量筒量取盐酸时量筒必须先润洗
B. 配制盐酸溶液时,容量瓶中少量的水不影响最终的浓度
C. 定容时观察液面俯视会造成所配溶液浓度偏低
D. 浓H2SO4稀释后即可注入容量瓶配制
难度: 中等查看答案及解析
-
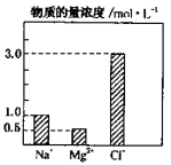
物质的量浓度相同的NaCl、MgCl2、AlCl3三种溶液,当溶液体积比为3∶2∶1时,三种溶液中c (Cl-) 之比为( )
A. l:2:3 B. 1:1:1 C. 3:2:l D. 3:4:3
难度: 中等查看答案及解析
-
已知反应:Cl﹣+ClO﹣+2H+=Cl2↑+H2O,下列说法正确的是
A.Cl﹣、ClO﹣在酸性溶液中不能大量共存
B.在无色碱性溶液中:ClO、Cl﹣、Fe2+、Na+能大量共存
C.洁厕灵(主要成分是盐酸)和84消毒液(主要成分是次氯酸钠)混合使用效果更好
D.符合该离子方程式的化学方程式可以是:HClO+HCl=Cl2↑+H2O
难度: 中等查看答案及解析
-
磁流体是电子材料的新秀。将含等物质的量的FeSO4 和Fe2(SO4)3 的溶液混合,再滴入稍过量的NaOH溶液,随后加入油酸钠溶液,即可生成黑色的、分散质粒子的直径在30~60 nm的磁流体,下列说法中不正确的是( )
A. 所得的分散系属于胶体 B. 用光束照射该分散系能产生丁达尔效应
C. 所得的分散系中分散质为Fe2O3 D. 分散系中分散质粒子直径大于Fe(OH)3 分子直径
难度: 中等查看答案及解析
-
下列各组离子一定能大量共存的是( )
A. 无色溶液中:Na+、Cu2+、NO3-、Cl-
B. 在酸性溶液中:Na+、K+、HCO3-、Cl-
C. 在含Fe2+的溶液中:Na+、Fe3+、I-、Cl-
D. 与铝单质反应产生气体的溶液:Na+、K+、Cl- 、SO42-
难度: 中等查看答案及解析
-
化学与社会、生活密切相关,下列有关物质的用途和原理分析正确的是
选项
物质的用途
原理和分析
A
漂白粉可用于食品漂白
漂白粉能使食品中的色素褪色
B
Al(OH)3可中和胃酸
Al(OH)3能与胃液中的酸发生中和反应
C
Na2O2常作供氧剂
Na2O2在常温下能分解放出O2
D
明矾可作净水剂
明矾溶于水后能消毒杀菌
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
设NA 为阿伏加德罗常数的数值,下列说法正确的是( )
A. 1molNa被完全氧化生成Na2O和Na2O2,失去NA 个电子
B. 常温常压下,22.4LHCl 中含有的原子总数为2 NA
C. 5.6 g 铁粉与0.1molCl2反应转移的电子数为0.3 NA
D. 标准状况下,l4g 氮气含有的核外电子数为5 NA
难度: 中等查看答案及解析
-
下列关于物质或离子检验的叙述正确的是( )
A. 往品红溶液中通入气体,红色褪去,证明气体一定是二氧化硫
B. 气体通过无水硫酸铜,粉末变蓝,证明原气体中含有水蒸气
C. 加入氯化钡溶液生成沉淀,再加入盐酸沉淀不溶解证明一定含有硫酸根
D. 将气体通入澄清石灰水,溶液变浑浊,证明原气体是CO2
难度: 中等查看答案及解析
-
下列离子方程式书写不正确的是( )
A. 铁和稀硫酸反应Fe+2H+=Fe2++H2↑
B. Ba(OH)2 溶液CuSO4 溶液混合Ba2++SO42-= BaSO4↓
C. 往偏铝酸钠溶液中通入过量的CO2:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-
D. 石灰石溶于醋酸CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑
难度: 中等查看答案及解析
-
水热法制备纳米颗粒Y(化合物)的反应为3Fe2++2S2O32-+O2+ aOH-=Y+S4O62-+bH2O,下列有关说法不正确的是( )
A. b=2
B. Y 的化学式为Fe3O4
C. S2O32-既不是氧化剂也不是还原剂
D. 每消耗3molFe2+,该反应转移电子数约为2.408×1024
难度: 中等查看答案及解析
-
下表列出了除去物质中所含杂质的方法,其中错误的是( )
选项
物质
所含杂质
除去杂质的方法
A
CO
CO2
通过足量的NaOH溶液,干燥
B
NaCl
泥沙
溶解、过滤、蒸发结晶
C
NaOH溶液
Na2CO3
加入稀盐酸至不再产生气泡
D
Cu(NO3)2
AgNO3
加入过量的铜粉,过滤
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
在同温同压下,向大小相同的气球分别充入CO 和以下四种混合气体,当体积相等时A、B、C、D 四个气球内,与充入CO 气球内所含原子数一定相等的是( )
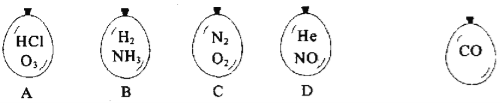
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
已知Na2SO3 固体与硫酸可发生反应:Na2SO3 + H2SO4=Na2SO4+H2O+SO2↑,下图是实验室制取SO2 并验证SO2的某些性质的装置图。回答正确的是( )
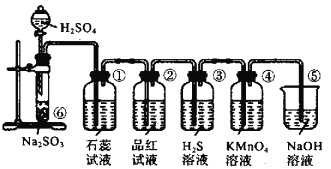
A. ①中的实验现象为紫色石蕊试液褪色此实验证明SO2 具有漂白性
B. ③中溶液变浑浊是因为SO2和H2S 发生了氧化还原反应,氧化产物和还原产物质量比为1∶1
C. ④和②中溶液均褪色,但褪色的原理不同
D. 实验室中可以用澄清石灰水代替氢氧化钠溶液
难度: 中等查看答案及解析
-
一定物质的量的CO2 与NaOH 溶液反应,所得溶液中含Na2CO3和NaHCO3,若两者物质的量之比为3∶5,则参加反应的CO2 与NaOH 的物质的量之比为( )
A. 3∶5 B. 1∶2 C. 18∶8 D. 8∶11
难度: 中等查看答案及解析