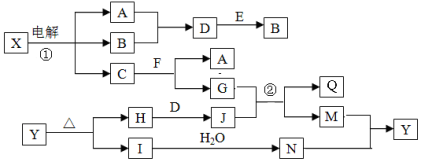
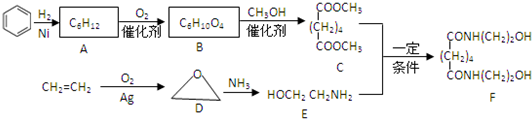
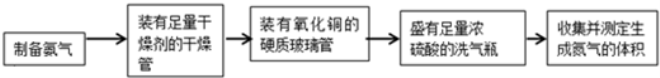
-
下列说法不正确的是
A.多孔碳可用作氢氧燃料电池的电极材料
B.油脂的皂化反应生成脂肪酸和丙醇
C.盐析可提纯蛋白质并保持其生理活性
D.l molNa与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子(NA表示阿伏加德罗常数)
难度: 中等查看答案及解析
-
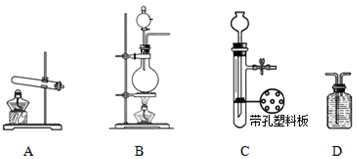
下列实验操作正确的是
A.中和滴定实验时,用待测液润洗锥形瓶
B.盛放NaOH溶液时,使用带玻璃塞的磨口瓶
C.用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出
D.NaCI溶液蒸发结晶时,蒸发皿中有晶体析出并剩余少量液体即停止加热
难度: 中等查看答案及解析
-
以下有关原予结构及元素周期律的叙述正确的是
A.同主族元素从上到下,单质的熔点逐渐降低
B.同周期元素(除0族元素外)从左到右,原子半径逐渐减小
C.第ⅦA族元素从上到下,其氢化物的稳定性逐渐增强
D.第IA族元素铯的两种同位素137Cs比133Cs多4个质子
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A.用铜作电极电解CuSO4溶液:2Cu2++2H2O电解2Cu+4H++O2↑
B.硅酸钠溶液与醋酸溶液混合:SiO32-+H+=H2SiO3↓
C.H2O2溶液中加入稀硫酸和KI溶液:H2O2+2H++2I-=I2+2H2O
D. Na2S2O3溶液中加入稀硫酸:2S2O32-+4H+=SO42-+3S↓+2H2O
难度: 中等查看答案及解析
-
草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,向10 mL 0.01 mol/LNaHC2O4溶液中滴加0.01 mol/L NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是
A.V(NaOH)=0时,c(H+)=1×10-2mol/L
B.V(NaOH)<10mL时,不可能存在c(Na+)=2c(C2O42-)+c(HC2O4- )
C.V(NaOH)=10 mL时,c(H+)=1×10-7mol/L
D.V(NaOH)>10 mL时,c(Na+)>c(C2O42-)>c(HC2O4- )
难度: 中等查看答案及解析
-
电镀废液中Cr2O72-可通过下列反应转化成铬黄(PbCrO4):
Cr2O72-(aq)+2Pb2+(aq)+ H2O(l)
2PbCrO4(s)+2H+(aq)△H<0
该反应达平衡后,改变横坐标表示的反应条件,下列示意图正确的是
A B C D
难度: 中等查看答案及解析