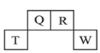
-
下列说法正确的是
A.浓硫酸能使蔗糖变黑,体现浓硫酸具有强酸化性
B.铵盐受热易分解,均有NH3产生
C.闪电时,N2转化为NO可以称为氮的固定
D.化工厂可通过加高烟囱排放废气,防止形成酸雨
难度: 简单查看答案及解析
-
下列变化中,能体现二氧化硫有还原性的是
A.将SO2气体通入含有氢氧化钠的酚酞溶液中,溶液褪色
B.将SO2气体通入澄清石灰水中,溶液变浑浊
C.将SO2通入品红溶液中,溶液褪色
D.将SO2气体通入碘水溶液中,溶液褪色
难度: 中等查看答案及解析
-
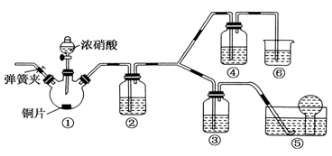
在硫酸工业生产中,为了有利于SO2的转化,且能充分利用热能,采用了中间有热交换器接触室(见下图)。按此密闭体系中气体的流向,则在A处流出的气体为
A.SO2 B.SO3、O2 C.SO2、SO3 D.SO2、O2
难度: 简单查看答案及解析
-
下列反应中HNO3既表现出酸性又表现出强氧化性的是
A.稀硝酸与CuO反应 B.稀硝酸与NaOH 溶液反应
C.浓硝酸与灼热的碳反应 D.浓硝酸与铜反应
难度: 中等查看答案及解析
-
下列气体既能用浓硫酸干燥又能用碱石灰干燥的是
A.SO2 B.NH3 C.N2 D.CO2
难度: 简单查看答案及解析
-
下列实验操作或对实验事实的叙述中,正确的是
A.用氨气做喷泉实验主要是利用氨气的水溶液呈碱性这一性质
B.向浓硫酸中缓慢加蒸馏水,以稀释浓硫酸
C.常温下,浓硝酸可贮存于铁制或铝制容器中
D.向溶液中加入硝酸酸化的BaCl2溶液,产生白色沉淀,说明一定含有SO42—
难度: 中等查看答案及解析
-
下列叙述不正确的是
A.NH3易液化,氨常用作制冷剂
B.NH4Cl中有少量的I2:通过加热的方法除去
C.铵盐受热易分解,因此贮存铵态氮肥时要密封保存,并放在阴凉通风处
D.浓硝酸需保存在棕色瓶中
难度: 中等查看答案及解析
-
已知元素X、Y的核电荷数分别是a和b,它们的离子Xm + 和Yn - 的核外电子排布相同,则下列关系式正确的是
A.a=b+m+n B.a = b-m+n C.a = b+m-n D.a=b-m-n
难度: 中等查看答案及解析
-
以下有关原子结构及元素周期律的叙述正确的是
A.第IA族元素铯的两种同位素137Cs比133Cs多4个质子
B.P、S、Cl得电子能力和最高价氧化物对应水化物的酸性均依次增强
C.第VIIA族元素从上到下,其氢化物的稳定性逐渐增强
D.元素的最高正价数均等于该元素原子的最外层电子数
难度: 中等查看答案及解析
-
元素在周期表中的位置反映了元素的原子结构和元素的性质,下列说法正确的是
A.同一元素不可能既表现金属性,又表现非金属性
B.第三周期元素的最高正化合价等于它所处的主族序数
C.短周期元素形成离子后,最外层电子都达到8电子稳定结构
D.同一主族的元素的原子,最外层电子数相同,化学性质完全相同
难度: 中等查看答案及解析
-
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示, 其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是
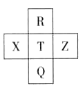
A.非金属性:T<X
B.R与Q的电子数相差16
C.气态氢化物稳定性:R <T<Q
D.最高价氧化物的水化物的酸性:T>Q
难度: 中等查看答案及解析
-
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:
下列有关物质的推断不正确的是
A.若甲为焦炭,则丁可能是O2
B.若甲为SO2,则丁可能是NaOH溶液
C.若甲为Fe,则丁可能是盐
D.若甲为NaOH溶液,则丁可能是CO2
难度: 中等查看答案及解析
-
在稀硫酸中加入铜粉,铜粉不溶,再加入下列物质,铜粉溶解的是
①FeCl3 ②Fe2O3 ③Cu(NO3)2 ④KNO3
A.只有①或② B.只有②或④
C.只有①或②或③ D.①②③④中任意一种
难度: 中等查看答案及解析
-
下列方程式不正确的是
A.向Fe(NO3)2溶液中加稀硝酸:3Fe2++4H++NO3-==3Fe3++NO↑+2H2O
B.向氯化铵的稀溶液中加入足量NaOH并加热:NH4++OH-
NH3↑+H2O
C.向(NH4)2SO4溶液中加入适量Ba(OH)2:Ba2++SO42-==BaSO4↓
D.向稀硝酸中加入铜片:3Cu+8H++2NO3-==3Cu2++2NO ↑+4H2O
难度: 中等查看答案及解析
-
某溶液能与Al粉反应放出H2,该溶液中可能大量共存的离子组是
A.NH4+、Ba2+、HCO3—、Cl- B.K+、Al3+、S2-、ClO-
C.Na+、Fe3+、Cl-、SO42— D.NH4+、Mg2+、SO42—、NO3—
难度: 中等查看答案及解析
-
如右图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了,则液体A和气体B的组合不可能是下列的
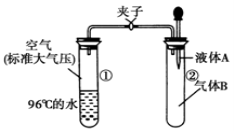
A.氢氧化钠溶液、二氧化碳 B.水、氨气
C.氢氧化钠溶液、一氧化氮 D.水、二氧化氮
难度: 中等查看答案及解析
-
下列物质之间的转化符合:“甲
乙
丙
丁”的组合是
①Na→NaOH; ②Cu→Cu(OH)2 ;③S→H2SO4 ;④NH3→HNO3
A.①②③ B.①③④ C.②③④ D.全部
难度: 中等查看答案及解析
-
在标准状况下将1.92g铜粉投入一定量浓HNO3中随着铜粉的溶解,反应生成的气体颜色逐渐变浅,当铜粉完全溶解后共收集到由NO2和NO组成的混和气体1.12L,则混和气体中NO的体积为
A.112mL B.1008mL C.224mL D.448mL
难度: 中等查看答案及解析
-
根据下表信息,判断以下叙述正确的是
部分短周期元素的原子半径及主要化合价
元素代号
L
M
Q
R
T
原子半径/nm
0.160
0.143
0.112
0.104
0.066
主要化合价
+2
+3
+2
+6、-2
-2
A.氢化物的沸点为H2T<H2R B.单质与稀盐酸反应的速度为L<Q
C.M与T形成的化合物具有两性 D.L2+与R2-的核外电子数相等
难度: 中等查看答案及解析
-
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示。若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是
A.原子半径:W>Z>Y>X
B.最高价氧化物对应水化物的酸性W比Z弱
C.Y的气态氢化物的稳定性较Z的弱
D.四种元素的单质中,Z的熔点最高
难度: 中等查看答案及解析