-
某学习小组探究浓、稀硝酸氧化性的相对强弱,按下图装置进行实验(夹持仪器已略去)。实验表明浓硝酸能将NO氧化成 ,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
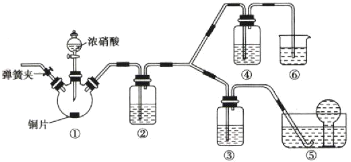
可选药品:浓硝酸、3mol/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳。
已知:氢氧化钠溶液不与NO反应,能与 反应:
反应: 。
。
(1)实验应避免有害气体排放到空气中,装置③、④、⑥中盛放的药品依次是_______________________________________。
(2)滴加浓硝酸之前的操作是检查装置的气密性,加入药品,打开弹簧夹后_______________________________________。
(3)装置①中发生反应的化学方程式是____________________________________________。
(4)装置②的作用是_____________________,发生反应的化学方程式是________________________________________。
(5)该小组得出的结论所依据的实验现象是_________________________________________。
-
(15分)某学习小组探究浓、稀硝酸氧化性的相对强弱,按下图装置进行实验(夹持仪器已略去)。实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
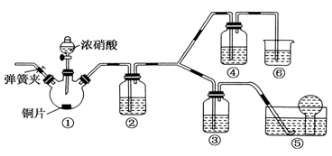
可选药品:浓硝酸、3 mol/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳。已知:氢氧化钠溶液不与NO反应,能与NO2反应。
2NO2+2NaOH====NaNO3+NaNO2+H2O
(1)实验应避免有害气体排放到空气中。装置③④⑥中盛放的药品依次是:
、 、 。
(2)装置①中发生反应的化学方程式是 。
(3)装置②的作用是 ,发生反应的化学方程式是 。
(4)若①中消耗铜片12.8g,产生的氮氧化物与O2完全反应转化为硝酸,试计算消耗标准状况下O2的体积为 L。
(5)该小组得出的结论所依据的实验现象是 。
(6)实验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色。甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体。同学们分别设计了以下4个实验来判断两种看法是否正确。这些方案中可行的是(选填序号字母) 。
A.加热该绿色溶液,观察颜色变化
B.加水稀释该绿色溶液,观察绿色变化
C.向该绿色溶液中通入氮气,观察颜色变化
D.向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化
-
某学习小组探究浓、稀硝酸氧化性的相对强弱,按下图装置进行实验(夹持仪器已略去)。实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
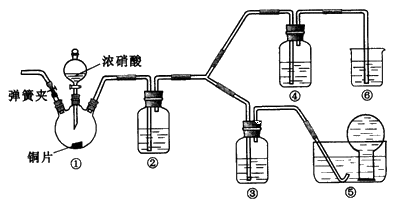
可选药品:浓硝酸、3mol/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳
已知:氢氧化钠溶液不与NO反应,能与NO2反应:2NO2+2NaOH=NaNO3+NaNO2+H,2O
(1)装置①中发生反应的离子方程式是 _______________________________________________________;
(2)装置②的目的是 ____________________,发生反应的化学方程式是 ____________________________________;
(3)实验应避免有害气体排放到空气中,装置③、④、⑥中盛放的药品依次是 ____________;
(4)实验的具体操作是:先检验装置的气密性,再加入药品,然后____________________,__________________
(此操作的目的是 _______________________________________________),最后滴加浓硝酸;
(5)该小组得出的结论所依据的实验现象是 ________________________________________________________。
-
某学习小组探究浓、稀硝酸氧化性的相对强弱,按下图装置进行实验(夹持仪器已略去)。实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
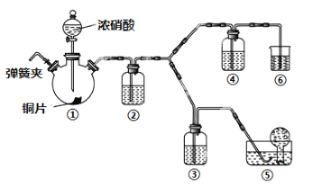
可选药品:浓硝酸、稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳。
已知:氢氧化钠溶液不与NO反应,能与NO2反应。2NO2+2NaOH=NaNO3+NaNO2+H2O
(1)实验应避免有害气体排放到空气中。装置③④⑥中盛放的药品依次是____、____、_______。
(2)滴加浓硝酸之前的一系列操作依次是检验装置的气密性,加入药品,打开弹簧夹后______。
(3)装置①中发生反应的化学方程式是___________。
(5)该小组得出的结论所依据的实验现象是_________。
-
某学习小组探究浓、稀硝酸氧化性的相对强弱,按下图装置进行实验(夹持仪器已略去)。实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
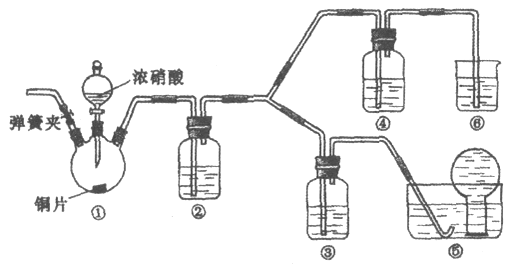
可选药品:浓硝酸、3 mol/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳
已知:氢氧化钠溶液不与NO反应,能与NO2反应2NO2+2 NaOH=NaNO3+NaNO2+H2O
(1)实验应避免有害气体排放到空气中。装置③、④、⑥中盛放的药品依次是_____。
(2)滴加浓硝酸之前的操作是检验装置的气密性,加入药品,打开弹簧夹后_______。
(3)装置①中发生反应的化学方程式是______。
(4)装置②的作用是_____,发生反应的化学方程式是______。
(5)该小组得出的结论所依据的实验现象是______。
(6)实验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色。甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体。同学们分别设计了以下4个实验来判断两种看法是否正确,这些方案中可行的是______。(选填字母)
a.加热该绿色溶液,观察颜色变化
b.加水稀释绿色溶液,观察颜色变化
c.向该绿色溶液中通入氮气,观察颜色变化
d.向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化
-
某学习小组探究浓、稀硝酸氧化性的相对强弱,按下图装置进行实验(夹持仪器已略去)。实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。

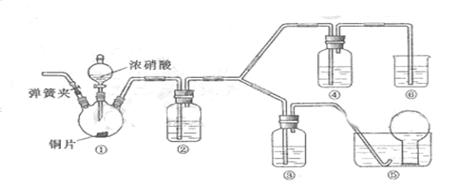
可选药品:浓硝酸、3mol/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳
已知:氢氧化钠溶液与NO不反应,能与NO2反应2NO2+2NaOH=NaNO3+ NaNO2+H2O
(1)实验应避免有害气体排放到空气中,装置③、⑥中盛放的药品依次是________
(2)滴加浓硝酸之前的操作是检验装置的气密性,加入药品后,还应进行哪些操作________
________再滴加浓硝酸与铜反应。
(3)装置①中发生反应的化学方程式是________
(4)装置②的作用是________,发生反应的化学方程式是
(5)该小组得出的结论依据的实验现象是________
-
某学习小组探究浓、稀硝酸氧化性的相对强弱,按下图装置进行实验(夹持仪器已略去)。实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
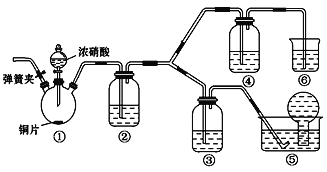
可选药品:浓硝酸、3 mol·L-1稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳。
已知:氢氧化钠溶液不与NO反应,能与NO2反应,
2NO2+2NaOHNaNO3+NaNO2+H2O。
(1)实验应避免有害气体排放到空气中。装置③、④、⑥中盛放的药品依次是______________、 ________、______________。
(2)滴加浓硝酸之前的操作是检验装置的气密性,加入药品,打开弹簧夹后_________________________________________________。
(3)装置①中发生反应的化学方程式是______________________________________。
(4)装置②的作用是_____________________________________________,
发生反应的化学方程式是______________________________________。
(5)该小组得出的结论所依据的实验现象是______________________________。
(6)实验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色。甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体。同学们分别设计了以下4个实验来判断两种看法是否正确,这些方案中可行的是________(填序号)。
a.加热该绿色溶液,观察颜色变化
b.加水稀释该绿色溶液,观察颜色变化
c.向该绿色溶液中通入氮气,观察颜色变化
d.向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化
-
某学习小组探究浓、稀硝酸氧化性的相对强弱,按下图装置进行实验(夹持仪器已略去)。实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。

可选药品:浓硝酸、3mo/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及CO2。
已知氢氧化钠溶液不与NO反应,能与NO2反应:2NO2+2NaOH=NaNO3+NaNO2+H2O。
(1)实验应避免有害气体排放到空气中,装置③、④、⑥中盛放的药品依次是________、
________、________。
(2)滴加浓硝酸之前,需打开弹簧夹,通入一段时间的CO2,其目的是________
________。
(3)装置①中发生反应的离子方程式是________。
(4)装置②的作用是________,发生反应的化学方程式是________。
(5)该小组得出的结论依据的实验现象是________。
(6)实验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色。甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体。同学们分别设计了以下4个试验来判断两种看法是否正确。这些方案中可行的是________。(可多选)
a.加热该绿色溶液,观察颜色变化
b.加水稀释绿色溶液,观察颜色变化
c.向该绿色溶液中通入氧气,观察颜色变化
d.向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化
-
某学习小组探究浓、稀硝酸氧化性的相对强弱,按下图装置进行试验(夹持仪器已略去)。实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
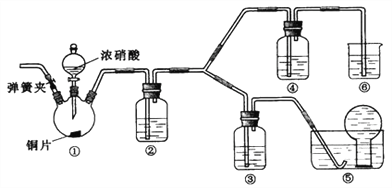
可选药品:浓硝酸、3mol/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳
已知:氢氧化钠溶液不与NO反应,能与NO2反应
(1)装置①中发生反应的化学方程式是__________
(2)滴加浓硝酸之前的操作是检验装置的气密性,加入药品,打开弹簧夹通入_________气体(填化学式)一段时间,关闭弹簧夹,将装置⑤中导管末端伸入倒置的烧瓶内。
(3)实验应避免有害气体排放到空气中,装置③中盛放的药品是_________;装置⑥中盛放的药品是_________。
(4)装置②中盛放的药品是_________;该装置的作用是_______________________。
(5)该小组得出的结论所依据的试验现象是__________________________________。
-
某学习小组探究浓、稀硝酸氧化性的相对强弱的,按下图装置进行试验(夹持仪器已略去).实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO.由此得出的结论是浓硝酸的氧化性强于稀硝酸.
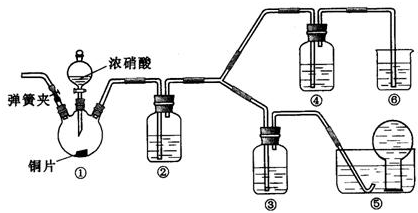
可选药品:浓硝酸、3mo/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳
已知:氢氧化钠溶液不与NO反应,能与NO2反应2NO2+2NaOH=NaNO3+NaNO2+H2O
(1)实验应避免有害气体排放到空气中,装置③、④、⑥中盛放的药品依次是________
(2)滴加浓硝酸之前的操作时检验装置的气密性,加入药品,打开弹簧夹后________
(3)装置①中发生反应的化学方程式是________
(4)装置②的作用是________,发生反应的化学方程式是________
(5)该小组得出的结论依据的试验现象是________
(6)试验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色.甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体.同学们分别涉及了一下4个试验来判断两种看法是否正确.这些方案中可行的是________(填序号字母,多选不给分)
a)加热该绿色溶液,观察颜色变化
b)加水稀释绿色溶液,观察颜色变化
c)向该绿色溶液中通入氮气,观察颜色变化
d)向饱和硝酸铜溶液中通入浓硝酸与铜反映产生的气体,观察颜色变化.









