-
下列图示关系不正确的是( )

难度: 简单查看答案及解析
-
下列有关能量的叙述错误的是( )
A.绿色植物进行光合作用时,将太阳能转化为化学能
B.物质发生化学反应过程中一定伴随着能量变化
C.可将反应“NaOH+HCl═NaCl+H2O”的化学能通过原电池转化为电能
D.化学反应使放热还是吸热,取决于生成物具有的总能量和反应物具有的总能量
难度: 简单查看答案及解析
-
下列有关金属腐蚀的说法错误的是( )
A.为保护地下钢管不受腐蚀,可使它与锌板或直流电源正极相连
B.在盛水的铁器中,空气与水交界处更容易锈蚀
C.为防止金属的腐蚀可在金属表面涂油漆或油脂
D.纯银器表面在空气中因化学腐蚀渐渐变暗
难度: 简单查看答案及解析
-
铜锌原电池(如图)工作时,下列叙述正确的是( )
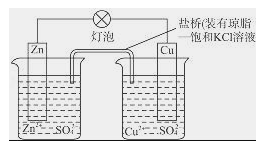
A.正极反应为:Zn﹣2e﹣═Zn2+
B.电池反应为:Zn+Cu2+═Zn2++Cu
C.在外电路中,电子从正极流向负极
D.盐桥中的K+移向ZnSO4溶液
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.工业上常通过电解熔融的MgO冶炼金属镁
B.应用盖斯定律,可计算某些难以直接测量的反应焓变
C.用惰性电极电解Na2SO4溶液,阴、阳两极产物的物质的量之比为1:2
D.在铁上镀铜,应选用铜作阴极
难度: 简单查看答案及解析
-
某化学反应在所有温度下都能自发进行,下列对该反应的叙述正确的是( )
A.放热反应,熵增加 B.放热反应,熵减小
C.吸热反应,熵增加 D.吸热反应,熵减小
难度: 简单查看答案及解析
-
已知Zn(s)+H2SO4(aq)===ZnSO4(aq)+H2(g) ΔH<0;则下列叙述不正确的是( )
A.该反应的ΔH值与反应物用量无关
B.该反应的化学能可以转化为电能
C.反应物的总能量高于生成物的总能量
D.该反应中反应物的化学键断裂放出能量,生成物的化学键形成吸收能量
难度: 简单查看答案及解析
-
对于反应NO2(g)+SO2(g)
SO3(g)+NO(g)。一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是( )
A.体系压强保持不变
B.混合气体颜色保持不变
C.SO3和NO的体积比保持不变
D.每消耗1 mol SO3的同时生成1 mol NO2
难度: 简单查看答案及解析
-
在容积可变的密闭容器中,2 mol N2和8 mol H2在一定条件下发生反应合成氨气,达到平衡时,H2的转化率为25%,则平衡时氮气的体积分数接近于 ( )
A.5% B.10% C.15% D.20%
难度: 简单查看答案及解析
-
加热N2O5,依次发生的分解反应为①N2O5(g)
N2O3(g)+O2(g) ②N2O3(g)
N2O(g)+ O2(g);在2 L密闭容器中充入8 mol N2O5,加热到t ℃,达到平衡状态后O2为9 mol,N2O3为3.4 mol。则t ℃时反应①的平衡常数为( )
A.10.7 B.8.5
C.9.6 D.10.2
难度: 简单查看答案及解析
-
化学平衡常数K的数值大小是衡量化学反应进行程度的标志,在常温下,下列反应的平衡常数的数值如下:2NO(g)
N2(g)+O2(g) K1=1×1030
2H2(g)+O2(g)
2H2O(l) K2=2×1081
2CO2(g)
2CO(g)+O2(g) K3=4×10-92 以下说法正确的是( )
A.常温下,NO分解产生O2的反应平衡常数表达式为K1=[N2][O2]
B.常温下,水分解产生O2,此时平衡常数的数值约为5×10-80
C.常温下,NO、H2O、CO2三种化合物分解放出O2的倾向由大到小的顺序为NO>H2O>CO2
D.以上说法都不正确
难度: 简单查看答案及解析
-
在一定条件下发生反应3A(g)+2B(g)
zC(g)+2D(g),在2L的密闭容器中把4 mol A和2 mol B混合,2 min后反应达到平衡时生成1.6 mol C,又测得D的浓度为0.4mol·L–1。则下列说法不正确的是( )
A.z=4
B.B的转化率是40%
C.A的平衡浓度是1.4 mol·L–1
D.平衡时气体压强是原来的1.2倍
难度: 简单查看答案及解析
-
已知:C(s)+H2O(g)=CO(g)+H2(g) △H=a kJ/mol
2C(s)+O2(g)=2CO(g) △H=-220 kJ/mol
H-H、O=O和O-H键的键能分别为436、496和462 kJ/mol,则a为( )
A.-332 B.+130 C.+350 D.-130
难度: 中等查看答案及解析
-
通过以下反应均可获取H2。下列有关说法正确的是( )
①太阳光催化分解水制氢:2H2O(l)=2H2(g)+ O2(g) ΔH1=571.6kJ·mol–1
②焦炭与水反应制氢:C(s)+ H2O(g) =CO(g)+ H2(g)ΔH2=131.3kJ·mol–1
③甲烷与水反应制氢:CH4(g)+ H2O(g)=CO(g)+3H2(g)ΔH3=206.1kJ·mol–1
A.反应①中电能转化为化学能
B.反应②为吸热反应
C.反应③使用催化剂,ΔH3减小
D.反应CH4(g)=C(s)+2H2(g)的ΔH=74.8kJ·mol–1
难度: 简单查看答案及解析
-
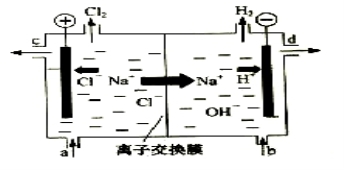
研究电化学腐蚀及防护的装置如右图所示。下列有关说法错误的是( )

A.d为石墨,铁片腐蚀加快
B.d为石墨,石墨上电极反应为:O2 + 2H2O + 4e → 4OH–
C.d为锌块,铁片不易被腐蚀
D.d为锌块,铁片上电极反应为:2H+ + 2e → H2↑
难度: 简单查看答案及解析
-
如右图,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中。下列分析正确的是( )

A.K1闭合,铁棒上发生的反应为2H++2e-→H2↑
B.K1闭合,石墨棒周围溶液pH逐渐升高
C.K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法
D.K2闭合,电路中通过0.002NA个电子时,两极共产生0.001mol气体
难度: 简单查看答案及解析
-
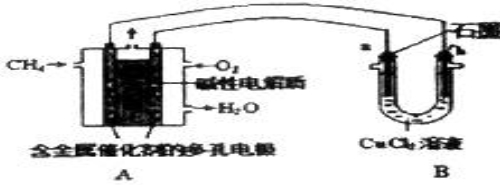
微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法不正确的是( )

A.正极反应中有CO2生成
B.微生物促进了反应中电子的转移
C.质子通过交换膜从正极区移向负极区
D.电池总反应为C6H12O6+6O2=6CO2+6H2O
难度: 简单查看答案及解析
-
为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。其反应原理如下:
电池:Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l);
电解池:2Al+3H2O
Al2O3+3H2↑
电解过程中,以下判断正确的是( )
电池
电解池
A
H+移向Pb电极
H+移向Pb电极
B
每消耗3molPb
生成1molAl2O3
C
正极:PbO2+4H++2e—=Pb2++2H2O
阳极:2Al+3H2O-6e—=Al2O3+6H+
D
难度: 困难查看答案及解析