-
化学反应原理在科研和生产中有广泛应用
(1)生产氢气:将水蒸气通过红热的炭即产生水煤气。
C(s)+H2O(g) H2(g)+CO(g)ΔH=+131.3 kJ·mol-1,ΔS=+133.7 J·mol-1·K-1,
H2(g)+CO(g)ΔH=+131.3 kJ·mol-1,ΔS=+133.7 J·mol-1·K-1,
该反应在低温下________(填“能”或“不能”)自发进行。
(2)利用“化学蒸气转移法”制备TaS2晶体,发生如下反应
TaS2(s)+2I2(g) TaI4(g)+S2(g)△H﹥0 (I)
TaI4(g)+S2(g)△H﹥0 (I)
反应(I)的平衡常数表达式K= ,若K=1,向某恒容密闭容器中加入1mol I2(g)和足量TaS2(s),I2(g)的平衡转化率为
(3)已知在400 ℃时,N2(g)+3H2(g) 2NH3(g)的K=0.5。
2NH3(g)的K=0.5。
①在400 ℃时,2NH3(g) N2(g)+3H2(g)的K′=___________(填数值)。
N2(g)+3H2(g)的K′=___________(填数值)。
②400 ℃时,在0.5 L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2 mol、1 mol、2 mol,则此时反应v(N2)正___________(填“>”“<”“=”或“不确定”)v(N2)逆。
(4) 离子液体是一种室温熔融盐,为非水体系。由有机阳离子、Al2Cl 和AlCl
和AlCl 组成的离子液体作电解液时,可在钢制品上电镀铝。钢制品接电源的___________极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为________________。为测定镀层厚度,用NaOH溶液溶解钢制品表面的铝镀层,当反应转移6 mol电子时,所得还原产物的物质的量为________mol。
组成的离子液体作电解液时,可在钢制品上电镀铝。钢制品接电源的___________极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为________________。为测定镀层厚度,用NaOH溶液溶解钢制品表面的铝镀层,当反应转移6 mol电子时,所得还原产物的物质的量为________mol。
-
运用化学反应原理研究合成氨反应有重要意义,请完成下列探究。
(1)生产氢气:将水蒸气通过红热的炭即产生水煤气。C(s)+H2O(g) H2(g)+CO(g) ΔH=+131.3kJ·mol-1,ΔS=+133.7J·mol-1·K-1,
H2(g)+CO(g) ΔH=+131.3kJ·mol-1,ΔS=+133.7J·mol-1·K-1,
①该反应在低温下___________(填“能”或“不能”)自发进行。
②写出该反应的平衡常数表达式_________________。
(2)已知在400℃时,N2(g)+3H2(g) 2NH3(g)的K=0.5。
2NH3(g)的K=0.5。
①在400℃时,2NH3(g) N2(g)+3H2(g)的K′=________(填数值)。
N2(g)+3H2(g)的K′=________(填数值)。
②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应v(N2)正________v(N2)逆(填“>”、“<”、“=”或“不能确定”)。
③若在恒温、恒压条件下向平衡体系中通入氩气,则合成氨反应的平衡________移动(填“向左”、“向左”或“不”);反应的ΔH__________(填“增大”、“减小”或“不改变”)。
(3)水煤气转化反应CO(g)+H2O(g)  CO2(g)+H2(g)在一定温度下达到化学平衡。现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下两组教据:
CO2(g)+H2(g)在一定温度下达到化学平衡。现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下两组教据:
| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min |
| CO | H2O | H2 | CO |
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 5 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| | | | | | |
① 实验l中以CO2表示的反应速率为v(CO2)=____________;
② 实验1的平衡常数K1__________实验2的平衡常数K2(填“大于””小于,“等于”“不能确定”)。
③ 该反应正方向为_____________(填“吸”或‘放”)热反应;
-
(8分)氨在国民经济中占有重要的地位,请参与下列探究。
(1)生产氢气:将水蒸气通过红热的炭即产生水煤气。
C(s) + H2O(g)  H2(g) + CO(g) △H = +131.3 kJ·mol-1 ,△S = +133.7 J/K
H2(g) + CO(g) △H = +131.3 kJ·mol-1 ,△S = +133.7 J/K
该反应在低温下能否自发________(填:能或否)。
(2)已知在400℃时,N2 (g)+ 3H2(g)  2NH3(g) △H<0 的K=0.5,
2NH3(g) △H<0 的K=0.5,
①2NH3(g) N2 (g)+ 3H2(g)的K= ________(填数值)。
N2 (g)+ 3H2(g)的K= ________(填数值)。
②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应
V(N2)正 ________V(N2)逆(填:>、<、=、不能确定)
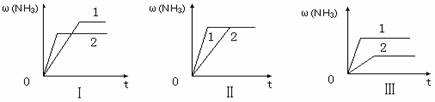
(3)在三个相同容器中各充入1 molN2和3molH2,在某一不同条件下反应并达到平衡,氨的体积分数随时间变化曲线如下图。下列说法正确的是 (填序号) 。
A.图Ⅰ可能是不同压强对反应的影响,且P2>P1
B.图Ⅱ可能是不同压强对反应的影响,且P1>P2
C.图Ⅲ可能是不同温度对反应的影响,且T1>T2
D.图Ⅱ可能是同温同压下,催化剂性能,1>2
-
(12分)氨在国民经济中占有重要的地位,请参与下列探究。
(1)生产氢气:将水蒸气通过红热的炭即产生水煤气。
C(s) + H2O(g) H2(g) + CO(g), ΔH = +131.3 kJ·mol-1,ΔS = +133.7 J·mol-1·K-1
H2(g) + CO(g), ΔH = +131.3 kJ·mol-1,ΔS = +133.7 J·mol-1·K-1
该反应在低温下能否自发进行________(填:“能”或“否”)。
(2)已知在400℃时,N2 (g)+ 3H2(g) 2NH3(g)的K=0.5,
2NH3(g)的K=0.5,
①2NH3(g) N2 (g)+ 3H2(g)的K=________(填数值)。
N2 (g)+ 3H2(g)的K=________(填数值)。
②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应v(N2)正________v(N2)逆(填:>、<、=、不能确定)
(3)在三个相同容器中各充入1 molN2和3molH2,在某一不同条件下反应并达到平衡,氨的体积分数随时间变化曲线如下图。下列说法正确的是________(填字母) 。
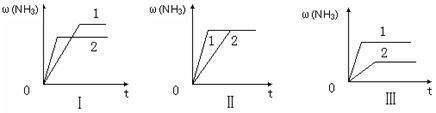
A.图Ⅰ可能是不同压强对反应的影响,且P2>P1
B.图Ⅱ可能是不同压强对反应的影响,且P1>P2
C.图Ⅲ可能是不同温度对反应的影响,且T1>T2
D.图Ⅱ可能是同温同压下,催化剂性能,1>2
-
(3分)氨在国民经济中占有重要的地位,请参与下列探究。
(1)生产氢气:将水蒸气通过红热的炭即产生水煤气。
C(s)+H2O(g) H2(g)+CO(g)表 ΔH=+131.3 kJ,ΔS=+133.7 J/K
H2(g)+CO(g)表 ΔH=+131.3 kJ,ΔS=+133.7 J/K
该反应在低温下能否自发反应__________(填“能”或“否”)。
(2)已知在400℃时,N2(g)+3H2(g) 2NH3(g)的K′=0.5。
2NH3(g)的K′=0.5。
①2NH3(g) N2(g)+3H2(g)的K=__________(填数值)。
N2(g)+3H2(g)的K=__________(填数值)。
②400℃时,在0.5 L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2 mol、1 mol、2 mol,则此时反应v(N2)正__________v(N2)逆(填“>”、“<”、“=”或“不确定”)。
-
运用化学反应原理研究合成氨反应有重要意义,请完成下列探究。
(1)生成氢气:将水蒸气通过红热的炭即产生水煤气。C(s)+H2O(g) H2(g)+CO(g) ΔH=+131.3 kJ·mol-1,ΔS=+133.7 J·mol-1·K-1,该反应在低温下________(“能”或“不能”)自发进行。
H2(g)+CO(g) ΔH=+131.3 kJ·mol-1,ΔS=+133.7 J·mol-1·K-1,该反应在低温下________(“能”或“不能”)自发进行。
(2)已知在400 ℃时,N2(g)+3H2(g) 2NH3(g)的K=0.5。
2NH3(g)的K=0.5。
①在400 ℃时,2NH3(g) N2(g)+3H2(g)的K′=________(填数值)。
N2(g)+3H2(g)的K′=________(填数值)。
②400 ℃时,在0.5 L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2 mol、1 mol、2 mol,则此时反应v正(N2)________(填“>”“<”“=”或“不能确定”)v逆(N2)。
③若在恒温、恒压条件下向平衡体系中通入氩气,则合成氨反应的平衡________(填“向左”“向右”或“不”)移动;使用催化剂________(填“增大”“减小”或“不改变”)反应的ΔH。
-
运用化学反应原理研究合成氨反应有重要意义,请完成下列探究。
(1)生成氢气:将水蒸气通过红热的炭即产生水煤气。C(s)+H2O(g) H2(g)+CO(g) ΔH=+131.3 kJ·mol-1,ΔS=+133.7 J·mol-1·K-1,该反应在低温下________(“能”或“不能”)自发进行。
H2(g)+CO(g) ΔH=+131.3 kJ·mol-1,ΔS=+133.7 J·mol-1·K-1,该反应在低温下________(“能”或“不能”)自发进行。
(2)已知在400 ℃时,N2(g)+3H2(g) 2NH3(g)的K=0.5。
2NH3(g)的K=0.5。
①在400 ℃时,2NH3(g) N2(g)+3H2(g)的K′=________(填数值)。
N2(g)+3H2(g)的K′=________(填数值)。
②400 ℃时,在0.5 L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2 mol、1 mol、2 mol,则此时反应v正(N2)________(填“>”“<”“=”或“不能确定”)v逆(N2)。
③若在恒温、恒压条件下向平衡体系中通入氩气,则合成氨反应的平衡________(填“向左”“向右”或“不”)移动;使用催化剂________(填“增大”“减小”或“不改变”)反应的ΔH。
-
I.“洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出了高热值的煤炭气,其主要成分是CO和H2。CO和H2可作为能源和化工原料,应用十分广泛.生产煤炭气的反应之一是:C(s)+H2O(g) CO(g)+H2(g) △H=+131.4kJ/mol
CO(g)+H2(g) △H=+131.4kJ/mol
(1)在容积为3L的密闭容器中发生上述反应,5min后容器内气体的密度增大了0.12g/L,用H2O表示0~5min的平均反应速率为 。
(2)关于上述反应在化学平衡状态时的描述正确的是 .
A.CO的含量保持不变 B.v正(H2O)=v正(H2)
C.容器中混合气体的平均相对分子质量保持不变
(3)若上述反应在t0时刻达到平衡(如图),在t1时刻改变某一条件,请在图中继续画出t1时刻之后正反应速率随时间的变化:

①缩小容器体积,t2时到达平衡(用实线表示);
②t3时平衡常数K值变大,t4到达平衡(用虚线表示)。
(4)在一定条件下用CO和H2可以制得甲醇(化学式为CH3OH),CH3OH和CO的燃烧热分别为725.8kJ/mol,283.0kJ/mol,1molH2O(l)变为H2O(g)吸收44.0 kJ的热量,写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式 。
II.实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减排的总体要求。试运用所学知识,解决下列问题:
(1)已知某反应的平衡常数表达式为: ,它所对应的化学方程式为 。
,它所对应的化学方程式为 。
(2)已知在400℃时,N2(g)+3H2(g) 2NH3(g)△H<0的K=0.5,则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应V(N2)正 V(N2)逆(填:>、<、=、不能确定)。欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积百分数增加,可采取的正确措施是 (填序号)
2NH3(g)△H<0的K=0.5,则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应V(N2)正 V(N2)逆(填:>、<、=、不能确定)。欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积百分数增加,可采取的正确措施是 (填序号)
A、缩小体积增大压强 B、升高温度 C、加催化剂 D、使氨气液化移走
-
化学反应原理在科研和生产中有广泛应用。
(1)利用“化学蒸气转移法”制备TaS2晶体,发生如下反应:
TaS2(s)+2I2(g) TaI4(g)+S2(g) (Ⅰ)
TaI4(g)+S2(g) (Ⅰ)
某温度反应(Ⅰ)的K=4,向某恒容密闭容器中加入1mol I2(g)和足量TaS2(s),I2(g)的平衡转化率为________ ________。
(2)如下图所示,反应(Ⅰ)在石英真空管中进行,先在温度高(T2)的一端放入未提纯的TaS2粉末和少量I2(g),加热一段时间后,在另一端温度低(T1)的一端得到了纯净的TaS2晶体,则该正反应的△H0(填“>”或“<”),上述反应体系中循环使用的物质是。

(3)上图为钠硫高能电池的结构示意图。该电池的工作温度为320℃左右,电池反应为2Na + xS=Na2Sx,正极的电极反应式为____________________________。M(由Na2O和Al2O3制得)的两个作用是________________________________________________和隔离钠与硫。
(4)写出Na2S溶液水解的离子方程式_______________________________________ ,Na2S溶液中c(H+)+ c(Na+)=________________。
-
化学反应原理在科研和生产中有广泛应用
(1)利用“化学蒸气转移法”制备TaS2晶体,发生如下反应TaS2(s)+2I2(g) TaI4(g)+S2(g)△H﹥0 (I)反应(I)的平衡常数表达式K= ,若K=1,向某恒容密闭容器中加入1mol I2(g)和足量TaS2(s),I2(g)的平衡转化率为 。
TaI4(g)+S2(g)△H﹥0 (I)反应(I)的平衡常数表达式K= ,若K=1,向某恒容密闭容器中加入1mol I2(g)和足量TaS2(s),I2(g)的平衡转化率为 。
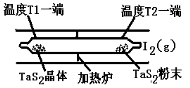
(2)如图所示,反应(I)在石英真空管中进行,先在温度为T2的一端放入未提纯的TaS2粉末和少量I2(g),一段时间后,在温度为T1的一端得到了纯净的TaS2晶体,则温度T1 T2(填“﹥”“﹤”或“=”)。上述反应体系中循环使用的物质是 。
(3)利用I2的氧化性可测定钢铁中硫的含量。做法是将钢铁中的硫转化为H2SO3,然后用一定浓度的I2溶液进行滴定,所用指示剂为 ,滴定反应的离子方程式为 。
(4)25℃时,H2SO3  HSO3-+H+的电离常数Ka=1×10-2mol/L,则该温度下NaHSO3的水解平衡常数Kh= mol/L,若向NaHSO3溶液中加入少量的I2,则溶液中
HSO3-+H+的电离常数Ka=1×10-2mol/L,则该温度下NaHSO3的水解平衡常数Kh= mol/L,若向NaHSO3溶液中加入少量的I2,则溶液中 将 (填“增大”“减小”或“不变”)。
将 (填“增大”“减小”或“不变”)。
H2(g)+CO(g)ΔH=+131.3 kJ·mol-1,ΔS=+133.7 J·mol-1·K-1,
TaI4(g)+S2(g)△H﹥0 (I)
2NH3(g)的K=0.5。
N2(g)+3H2(g)的K′=___________(填数值)。
和AlCl
组成的离子液体作电解液时,可在钢制品上电镀铝。钢制品接电源的___________极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为________________。为测定镀层厚度,用NaOH溶液溶解钢制品表面的铝镀层,当反应转移6 mol电子时,所得还原产物的物质的量为________mol。




