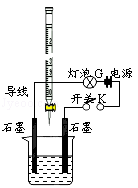
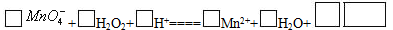-
下列物质属于强电解质且能导电的是( )
①氯化钠溶液 ②氯化铵固体 ③铜 ④石墨 ⑤熔融NaOH ⑥稀硫酸 ⑦乙酸
A.⑤ B.①②⑥ C.②⑤⑥⑦ D.①③④⑤⑥
难度: 简单查看答案及解析
-
下列过程或现象与盐类水解无关的是( )
A.可用碳酸钠与醋酸制取少量二氧化碳
B.泡沫灭火器用碳酸氢钠溶液和硫酸铝溶液,使用时只需将其混合就可产生大量二氧化碳的泡沫
C.厨房中常用碳酸钠溶液洗涤餐具上的油污
D.实验室盛放碳酸钠溶液的试剂瓶必须用橡胶塞而不能用玻璃塞
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.将FeCl3溶液加热蒸干,可得到FeCl3固体;
B.将PH=9的KOH溶液稀释1000倍后,其PH=6;
C.用NaOH溶液滴定醋酸溶液时,不宜选用甲基橙作指示剂;
D.碳酸溶液中氢离子浓度是碳酸根离子浓度的二倍
难度: 中等查看答案及解析
-
常温下,pH = 12的氢氧化钠和pH = 4的醋酸等体积混合后恰好完全反应,忽略混合后溶液体积的变化,下列说法中正确的是( )
A.混合前的醋酸约1%发生电离 B.混合后的溶液中c(Na+)=c(CH3COO—)
C.氢氧化钠和醋酸的浓度不相等 D.混合后的溶液呈中性
难度: 中等查看答案及解析
-
室温下,用0.1mol/L氨水分别滴定20.00mL、0.1mol/L的盐酸和醋酸,曲线如图所示,下列说法正确的( )

A.I曲线表示的是滴定盐酸的曲线
B.滴定过程中
的值逐渐减小
C.x=20
D.当I曲线和II曲线pH均为7时,一溶液中的c(Cl﹣)等于另一溶液中的c(CH3COO-)
难度: 困难查看答案及解析
-
将等物质的量的F2和ClF混合,在密闭容器中发生反应: F2(g)+ClF(g)
ClF3(g)
△H<0。下列叙述中,正确的是( )
A.恒温恒容时,当ClF 转化40% 时,容器内的压强为初始时的0.9 倍
B.若 c(F2):c (ClF): c (ClF3) =1: 1: 1, 则反应一定达到平衡状态
C.达到平衡后,若增大容器体积,则正反应速率减小,逆反应速率增大,平衡左移
D.平衡后再降低温度,保持恒容,达到新的平衡,则混合气体的平均摩尔质量增大
难度: 中等查看答案及解析
-
下列各组离子能在指定溶液中可以大量共存的是( )
①无色溶液中:K+、Cu2+、Na+、H2PO4-、PO43-、SO42-
②pH=11的溶液中:CO32-、Na+、AlO2-、NO3-、S2-、SO32-
③水电离的H+浓度为10-12mol·L-1的溶液中:Cl-、NO3-、NH4+、S2O32-
④加入Mg能放出H2的溶液中:Mg2+、NH4+、Cl-、K+、SO42-
⑤使甲基橙变红的溶液中:Fe3+、MnO4-、NO3-、Na+、SO42-
⑥酸性溶液中:Fe2+、Al3+、NO3-、I-、Cl-、S2-
A.②④⑤ B.①③⑥ C.①②⑤ D.②④⑥
难度: 困难查看答案及解析
-
在一定温度下,将6 mol C02和8 mol H2充入2L恒容密闭容器中,发生反应:C02(g)+3H2(g)
CH30H(g)+H20(g) △H<O,一段时间后达到平衡。反应过程中测定的数据如下表。下列说法正确的是( )
A.反应前4min的平均速率v(C02)= 0.45 mol/(L min)
B.该温度下,该反应的平衡常数为0.5
C.其他条件不变,升高温度,反应达到新平衡时CH30H的体积分数增大
D.达到平衡时,H2的转化率为25%
难度: 中等查看答案及解析
-
一定温度下,将0.1molAgCl固体加入1L 0.1mol·L﹣1Na2CO3溶液中,充分搅拌(不考虑液体体积变化),已知:Ksp(AgCl)=2×10﹣10;Ksp(Ag2CO3)=1×10﹣11,下列有关说法正确的是( )
A.沉淀转化反应2AgCl(s)+CO32﹣(aq)
Ag2CO3(s)+2Cl﹣(aq)的平衡常数为20mol·L﹣1
B.约有10﹣5mol AgCl溶解
C.反应后溶液中的:c(Na+)+c(Ag+)+c(H+)=2c(CO32﹣)+c(HCO3﹣)+c(Cl﹣)+c(OH-)
D.反应后溶液中的: c(Na+)>c(CO32﹣)>c(Cl﹣)>c(Ag+)>c(H+)
难度: 困难查看答案及解析
-
下列有关实验操作、现象和解释或结论都正确的是( )
选项
实验操作与现象
解释或结论
A
过量的铁粉中加入稀硝酸中,充分反应后,滴入KSCN溶液,溶液呈红色
稀硝酸将Fe氧化为Fe3+
B
AgI固体中滴入KCl溶液,沉淀由黄色变为白色
AgI比AgCl难溶
C
铝箔插入稀硝酸中,无现象
铝箔表面被硝酸氧化,形成致密的氧化膜
D
苯酚溶液中滴加溴水,出现白色沉淀
苯酚易发生取代反应
难度: 中等查看答案及解析
-
有两种一元弱酸的钠盐溶液,其物质的量浓度相等,现向这两种盐的溶液中分别通入适量的CO2,发生如下反应:NaR+CO2+H2O=HR+NaHCO3;2NaR1+CO2+H2O
2HR1+Na2CO3。HR和HR1的酸性强弱比较,正确的是 ( )
A.HR较弱 B.HR1较弱 C.两者相同 D.无法比较
难度: 中等查看答案及解析
-
有关下列图象的分析错误的是( )
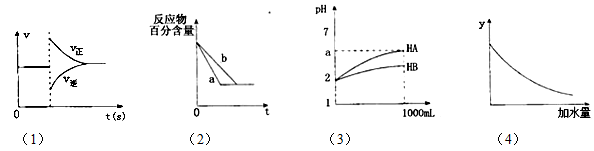
A.图(1)可表示对平衡N2+3H2
2NH3加压、同时移除部分NH3时的速率变化
B.图(2)中a、b曲线只可表示反应H2(g)十I2(g)
2HI(g)在有催化剂和无催化剂存在下建立平衡的过程
C.图(3)表示室温下将各1 ml pH=2的HA、HB两种酸溶液加水稀释的情况.若2<a<5,则两酸都为弱酸
D.图(4)中的y可表示将0.1 mol/L稀醋酸加水稀释时溶液导电能力的变化情况
难度: 困难查看答案及解析
-
下列说法错误的是( )
①NaHCO3溶液加水稀释,c(Na+)/ c(HCO3-)的比值保持增大
②浓度均为0.1 mol·L1的Na2CO3、NaHCO3混合溶液:2c(Na+)=3[c(CO32-)+c(HCO3-)]
③在0.1 mol·L1氨水中滴加0.lmol·L1盐酸,恰好完全反应时溶液的pH=a,则由水电离产生的c(OH-)=l0-amol·L-1
④向0.1mol/LNa2SO3溶液中加入少量NaOH固体,c(Na+)、c(SO32-)均增大
⑤浓度相等的a、NH4HSO4溶液、b、NH4HCO3溶液、c、NH4Cl溶液中的c(NH4+):①>②>③
⑥NaHSO3溶液显酸性,c(Na+)>c(HSO3﹣)>c(H+)>c(OH﹣)>c(SO32﹣)
⑦常温下,CH3COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1 mol·L-1]:c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-)
⑧pH=3.6的0.1mol/L HX与0.1mol/L NaX的混合溶液中,c(H+)-c(OH-)=c(X-)-c(HX)
A.②④⑥⑦ B.②⑤⑦⑧ C.①③⑤⑥ D.②⑤⑥⑧
难度: 极难查看答案及解析
-
向一定量的K2CO3溶液中缓慢地滴加稀盐酸,并不断搅拌。随着盐酸的加入,溶液中离子数目也相应地发生变化。如图所示,四条曲线与溶液中的离子数目的对应关系,完全正确的是( )
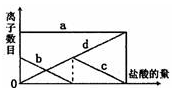
A.a:K+; b:HCO3—;c:CO32—;d:Cl—
B.a:K+; b:CO32—;c:HCO3—;d:Cl—
C.a:K+; b:CO32—;c:Cl—;d:HCO3—
D.a:K+; b:HCO3—;c:Cl—;d:CO32—
难度: 极难查看答案及解析
-
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示:
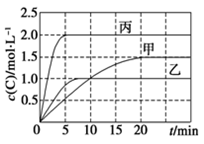
容器
甲
乙
丙
容积
0.5 L
0.5 L
1.0 L
温度/℃
T1
T2
T2
反应物起始量
1.5 mol A
0.5 mol B
1.5 mol A
0.5 mol B
6.0 mol A
2.0 mol B
下列说法正确的是( )
A.10min内甲容器中反应的平均速率v(A)=0.025 mol·L-1·min-1
B.由图可知:T1<T2,且该反应为吸热反应
C.若平衡时保持温度不变,改变容器体积平衡不移动
D.T1℃,起始时甲容器中充入0.5 mol A、1.5 mol B,平衡时A的转化率为25%
难度: 极难查看答案及解析
-
一定温度下的可逆反应:A(s)+2B(g)
2C(g)+D(g)△H<0.现将1mol A和2molB加入甲容器中,将4molC和2mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动).下列说法正确的是( )

A.保持温度和活塞位置不变,在甲中再加入1molA和2molB,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍
B.保持活塞位置不变,升高温度,达到新的平衡后,甲中B的体积分数增大,乙中B的体积分数减小
C.保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍
D.保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略)
难度: 极难查看答案及解析