-
(14分)某温度下,水的离子积Kw=l×10-13。有酸溶液A,pH=a;碱溶液B,pH=b。为测定A、B混合后溶液导电性的变化以及探究A、B的相关性质,某同学设计了如图所示的实验装置。

(1)实验时,烧杯中应盛 (选A或B)溶液。
(2)若A为一元强酸,B为一元强碱,且a+b=13。该同学在烧杯中先加入其中一种溶液,闭合开关K,测得烧杯中灯泡的亮度为10(假设亮度由暗到亮表示为1、2、3、…10、11、12、… 20)。断开开关K,将滴定管中的溶液逐滴加入到烧杯中。当从滴定管滴入烧杯中的溶液体积和烧杯中盛有的溶液体积相等时,停止滴加溶液并闭合开关K,此时灯泡G的亮度约为 ,原因是 。烧杯中得到的溶液pH= 。
(3)若A为强酸,B为强碱,且a+b=13。断开开关K,将滴定管中的溶液逐滴加入到烧杯中。当测得烧杯中溶液pH和“⑵”中最后得到的溶液pH相同时,停止滴加溶液。此时烧杯中的溶液中阳离子浓度大于阴离子浓度,原因可能是 。
(4)若A的化学式为HR,B的化学式为MOH,且a+b=13,两者等体积混合后溶液显碱性。则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式为_ _。
此时烧杯中的混合溶液中,微粒浓度大小关系一定正确的是_ _____(填序号)。
①c(MOH)>c(M+)>C(R-)>c(H+)>c(OH-)
②c(HR)>c(M+)>c(R-)>c(OH-)>c(H+)
③c(R-)>c(M+)>c(H+)>c(OH-)
④c(M+)>c(R-)>c(OH-)>c(H+)
⑤c(M+)+ c(H+)=c(R-)+c(OH-)
⑥c(MOH)=c(H+)-c(OH-)
-
(10分)某温度下,水的离子积Kw=l×10-13。有酸溶液A,pH=a;碱溶液B,pH=b。为测定A、B混合后溶液导电性的变化以及探究A、B的相关性质,某同学设计了如图所示的实验装置。

(1)实验时,烧杯中应盛 (选A或B)溶液。
(2)若A为一元强酸,B为一元强碱,且a+b=13。该同学在烧杯中先加入其中一种溶液,闭合开关K,测得烧杯中灯泡的亮度为10(假设亮度由暗到亮表示为1、2、3、…10、11、12、… 20)。断开开关K,将滴定管中的溶液逐滴加入到烧杯中。当从滴定管滴入烧杯中的溶液体积和烧杯中盛有的溶液体积相等时,停止滴加溶液并闭合开关K,此时灯泡G的亮度约为 ,原因是 。烧杯中得到的溶液pH= 。
(3)若A为强酸,B为强碱,且a+b=13。断开开关K,将滴定管中的溶液逐滴加入到烧杯中。当测得烧杯中溶液pH和“(2)”中最后得到的溶液pH相同时,停止滴加溶液。此时烧杯中的溶液中阳离子浓度大于阴离子浓度,原因可能是 。
(4)若A的化学式为HR,B的化学式为MOH,且a+b=13,两者等体积混合后溶液显碱性。则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式为____ ____。
此时烧杯中的混合溶液中,微粒浓度大小关系一定正确的是___ ___(填序号)。
①c(MOH)>c(M+)>C(R-)>c(H+)>c(OH-)
②c(HR)>c(M+)>c(R-)>c(OH-)>c(H+)
③c(R-)>c(M+)>c(H+)>c(OH-)
④c(M+)>c(R-)>c(OH-)>c(H+)
⑤c(M+)+ c(H+)=c(R-)+c(OH-)
⑥c(MOH)=c(H+)-c(OH-)
-
有酸溶液A,pH=a;碱溶液B,pH=b.为测定A、B混合后溶液导电性的变化以及探究A、B的相关性质,某同学设计了如图所示的实验装置.常温下,水的离子积
Kw=1×10﹣14.
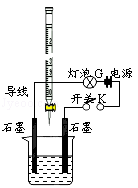
(1)实验时,滴定管中应盛 (选A或B)溶液.
(2)若A为一元强酸,B为一元强碱,且a+b=14.该同学在烧杯中先加入其中一种溶液,闭合开关K,测得烧杯中灯泡的亮度为10(假设亮度由暗到亮表示为1、2、3、…10、11、12、…20).断开开关K,将滴定管中的溶液逐滴加入到烧杯中.当从滴定管滴入烧杯中的溶液体积和烧杯中盛有的溶液体积相等时,停止滴加溶液并闭合开关K,此时灯泡G的亮度约为 ,原因是 .烧杯中得到的溶液pH= .
(3)若A为强酸,B为强碱,且a+b=14.断开开关K,将滴定管中的溶液逐滴加入到烧杯中.当测得烧杯中溶液pH和“(2)”中最后得到的溶液pH相同时,停止滴加溶液.此时烧杯中的溶液中阳离子浓度大于阴离子浓度,原因可能是 .
(4)若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显酸性.则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程为 .此时烧杯中的混合溶液中,微粒浓度大小关系一定正确的是 (填序号).
①c(MOH)>c(M+)>c(R﹣)>c(H+)>c(OH﹣)
②c(HR)>c(M+)>c(R﹣)>c(OH﹣)>c(H+)
③c(R﹣)>c(M+)>c(H+)>c(OH﹣)
④c(M+)>c(R﹣)>c(OH﹣)>c(H+)
⑤c(M+)+c(H+)=c(R﹣)+c(OH﹣)
⑥c(MOH)=c(H+)﹣c(OH﹣)
-
某同学探究氨和铵盐的性质,相关实验操作及现象描述正确的是
A.室温下测定等浓度氨水和NaOH溶液的pH,比较氨水和NaOH碱性强弱
B.将氨水缓慢滴入AlCl3溶液中,研究Al(OH)3的两性
C.将蘸有浓氨水和浓硫酸的玻璃棒靠近,观察到白烟
D.加热除去NH4C1中的少量NaHCO3
-
一定温度下,将一定质量的纯醋酸加水稀释,经实验测定溶液的导电能力变化如图所示,下列说法中正确的是
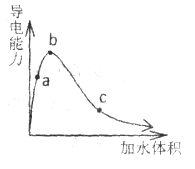
A. a、b、c三点溶液的pH: 
B. a、b、c三点醋酸的电离程度: 
C. 若用湿润的pH试纸测量a处的pH,测量结果偏小
D. 物质的量浓度分别为a、b、c三点的溶液各 ,用
,用 氢氧化钠溶液中和,消耗氢氧化钠溶液体积:
氢氧化钠溶液中和,消耗氢氧化钠溶液体积: 
-
氢氰酸(HCN)的下列性质中,不能说明它是弱电解质的是( )
A. 1 mol·L-1氢氰酸溶液的pH约为3
B. 同浓度的盐酸比HCN溶液导电性强
C. 同浓度同体积的HCN溶液和NaOH溶液混合,溶液呈碱性
D. 10 mL 1 mol·L-1HCN恰好与10 mL 1 mol·L-1 NaOH溶液完全反应
-
醋酸的下列性质中,不能说明它是弱电解质的是
A. 1 mol·L-1醋酸溶液的pH约为3
B. 同浓度的盐酸比醋酸溶液导电性强
C. 同浓度同体积的CH3COOH溶液和NaOH溶液混合,溶液呈碱性
D. 10 mL 1 mol·L-1CH3COOH恰好与10 mL 1 mol·L-1 NaOH溶液完全反应
-
现有某铁碳合金(铁和碳两种单质的混合物),某化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图所示的实验装置(夹持仪器已省略)和实验方案进行实验探究。
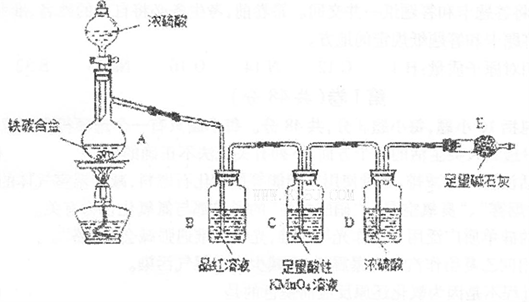
I.测定铁的质量分数:
(1)检查上述装置气密性的一种方法是:关闭分液漏斗的活塞,在E装置后面连上一根
导管,然后________________________________________,则证明装置的气密性良好。
(2)称量E的质量,并将a g铁碳合金样品放入装置A中,再加入足量的浓硫酸,待A中不再逸出气体时,停止加热,拆下E并称重,E增重bg。铁碳合金中铁的质量分数为_____________________________________________(写表达式)。
(3)装置C中反应的离子方程式为________________________________________。
(4)甲同学认为,依据此实验测得的数据,计算合金中铁的质量分数可能会偏低,原因是空气中CO2、H2O进入E管使b增大。你认为改进的方法是____________________________________.
(5)乙同学认为,即使甲同学认为的偏差得到改进,依据此实验测得合金中铁的质量分
数也可能会偏离。你认为其中的原因是_________________________________________。
Ⅱ.探究浓硫酸的某些性质:
(6)往A中滴加足量的滚硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是:
_____________________________________________________________________。
(7)将A中固体换为金属铜则与浓硫酸发生反应的化学方程式是__________________
_______________________,反应中浓硫酸表现出的性质是______________________。
-
现有某铁碳合金(铁和碳两种单质的混合物),某化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图所示的实验装置(夹持仪器已省略)和实验方案进行实验探究。
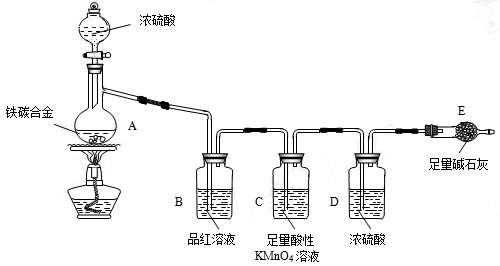
I 测定铁的质量分数:(1)检查上述装置气密性的一种方法是:关闭分液漏斗的活塞,在E装置后面连上一根导管,然后_____________________________________________,则证明装置的气密性良好。
(2)称量E的质量,并将a g铁碳合金样品放入装置A中,再加入足量的浓硫酸,待A中不再逸出气体时,停止加热,拆下E并称重,E增重b g。铁碳合金中铁的质量分数为______________________(写表达式)。
(3)装置C的作用______________________________________________。
(4)甲同学认为,依据此实验测得的数据,计算合金中铁的质量分数可能会偏低,原因是空气中CO2、水蒸气进入E管使b增大。你认为改进的方法是_______________________。
(5)乙同学认为,即使甲同学认为的偏差得到改进,依据此实验测得合金中铁的质量分数也可能会偏高。你认为其中的原因是__________________________________________。
Ⅱ 探究浓硫酸的某些性质:
(6)往A中滴加足量的浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是:_______________________________________________________。
(7)A中铁与浓硫酸发生反应的化学方程式是_________________________________。
-
(11分)
某化学兴趣小组想探究某一温度下氯化钠饱和溶液的酸碱度。探究过程如下:
【猜想或假设】溶液的pH可能为:①pH<7,② ,③ 。
【设计和实验】要测定该溶液的酸碱度,除有正确的操作步骤外,其中不能采用下列物质中的 (填序号)来进行实验。
①pH试纸 ②紫色石蕊试液 ③酚酞试液
组内同学进行了如下实验:
甲同学:取pH试纸放在玻璃片上,用玻璃棒蘸取氯化钠溶液沾在pH试纸上,把试纸显示的颜色与标准比色卡比较,测得pH=7。
乙同学:取pH试纸放在玻璃片上,先用蒸馏水将pH试纸润湿,然后用玻璃棒蘸取氯化钠溶液沾在pH试纸上,把试纸显示的颜色与标准比色卡比较,测得pH=7。
丙同学:将pH试纸直接浸入氯化钠溶液中,把试纸显示的颜色与标准比色卡比较,测得pH=7。
【评价与反思】三位同学中操作正确的是 同学。
指出其于同学的操作错误:
同学: ;
同学: ;
【结论与分析】丙同学得出:“凡是盐溶液的pH都等于7”,你认为该同学结论
(填“正确”或“不正确”)。
如不正确,请举一例说明 (如正确,该处不填)。





