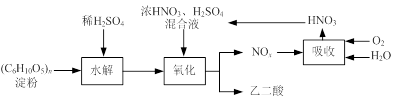
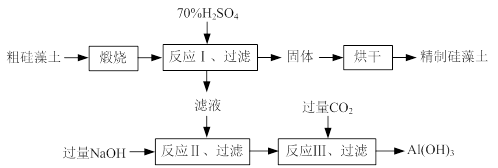
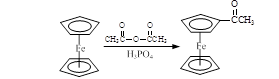
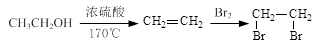-
化学家认为石油、煤作为能源使用时,燃烧了“未来的原始材料”。下列对上述观点理解正确的是
A.大力提倡使用廉价化石燃料作为能源
B.应更多地利用石油和煤生产基本化工原料
C.化石燃料属于可再生能源,不影响可持续发展
D.研发新型催化剂,提高石油和煤中各组分的燃烧热
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是
A.氢氧化钠的电子式:
B. Cl-的结构示意图:
C.2-丁醇的结构简式:
D.碳酸的电离方程式:H2CO3=2H++CO32-
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.0.1 mol·L-1 KNO3溶液:Mg2+、Fe2+、Cl-、SO42-
B.无色透明的溶液:Cu2+、NH4+、NO3-、CO32-
C.使pH试纸变红的溶液:K+、Ca2+、Cl-、ClO-
D.水电离出的c(H+)=10-12 mol·L-1的溶液:Na+、NH4+、SO42-、NO3-
难度: 中等查看答案及解析
-
下表为六种短周期元素的部分性质。
元素代号
X
Y
Z
Q
R
T
原子半径/10-10m
0.37
0.74
0.75
0.82
0.99
1.10
主要化合价
+1
-2
+5、-3
+3
+7、-1
+5、-3
下列有关说法正确的是
A.元素X、Y、Z形成的化合物一定是离子化合物
B.元素R的氧化物对应水化物一定为强酸
C.化合物QR3分子中各原子均满足8电子稳定结构
D.元素Z的简单气态氢化物的热稳定性比元素T的稳定
难度: 困难查看答案及解析
-
下列有关物质的性质与应用相对应的是
A.炭具有强还原性,常用于冶炼镁、钠等金属
B.铝的金属性较强,可用作飞机、火箭的结构材料
C.碳酸钠溶液呈碱性,可用于洗去铁屑表面的油污
D.浓硫酸具有强氧化性,可用于与亚硫酸钠反应制取二氧化硫
难度: 中等查看答案及解析
-
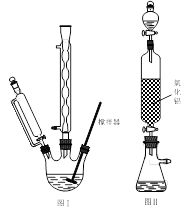
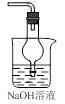
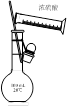
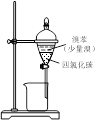
用下列实验装置进行相应实验,能达到实验目的的是
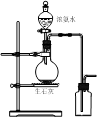
图Ⅰ 图Ⅱ 图Ⅲ 图Ⅳ
A.用图Ⅰ所示装置吸收尾气中的二氧化硫
B.用图Ⅱ所示装置配制100 mL 0.100 mol·L-1稀硫酸
C.用图Ⅲ所示装置除去溴苯中少量的溴
D.用图Ⅳ所示装置制取并收集氨气
难度: 中等查看答案及解析
-
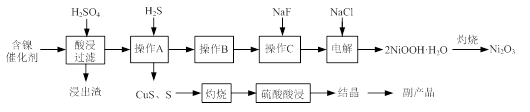
硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如下图所示)。下列说法错误的是
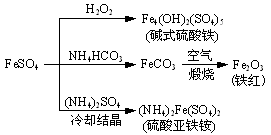
A.碱式硫酸铁水解能产生Fe(OH)3胶体,可用作净水剂
B.为防止NH4HCO3分解,生产FeCO3需在较低温度下进行
C.可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化
D.常温下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的大
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列叙述正确的是
A.标准状况下,2.24 L 水中所含电子总数为NA
B.1 L 0.2 mol·L-1硫酸铁溶液中含有的SO42-数为0.2NA
C.苯和苯甲酸混合物1 mol,完全燃烧消耗O2的分子数为7.5NA
D.标准状况下,7.1 g氯气与足量石灰乳充分反应转移电子数为0.2NA
难度: 中等查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是
A.用氨水溶解氯化银沉淀:Ag++2 NH3·H2O=[Ag(NH3)2]++2H2O
B.二氧化硫通入氯化铁溶液:SO2+2Fe3++2H2O=SO42-+2Fe2++4H+
C.硫酸氢铵溶液中滴加少量NaOH溶液:H++NH4++2OH-=NH3·H2O+H2O
D.碱性条件下铝粉还原NaNO2:NO2-+2Al+3OH-+H2O=2AlO2-+NH3·H2O
难度: 中等查看答案及解析
-
下列有关说法正确的是
A.锌与稀硫酸反应时加入少量硫酸铜,反应加快的原因是Cu2+水解增大了H+浓度
B.增大醋酸溶液的浓度,溶液中c(OH-)减小的原因是水的离子积Kw 减小
C.pH=3的盐酸与pH=11的LiOH溶液等体积混合溶液呈碱性,说明LiOH为强碱
D.TATP(C8H18O6)受撞击分解爆炸,且无明显热效应,说明该分解反应熵显著增加
难度: 中等查看答案及解析
-
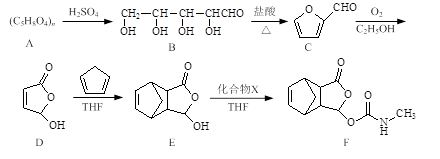
依曲替酯是一种皮肤病用药,它可以由原料X经过多步反应合成。
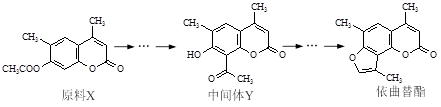
下列说法正确的是
A.原料X与中间体Y互为同分异构体
B.原料X可以使酸性KMnO4溶液褪色
C.中间体Y能发生加成、取代、消去反应
D.1 mol依曲替酯只能与1 mol NaOH发生反应
难度: 困难查看答案及解析
-
下图是某同学设计的原电池装置,下列叙述中正确的是
A.电极Ⅰ上发生还原反应,作原电池的正极
B.电极Ⅱ的电极反应式为:Cu2++2e-= Cu
C.该原电池的总反应为:2Fe3++Cu= Cu2++2Fe2+
D.盐桥中装有含氯化钾的琼脂,其作用是传递电子
难度: 中等查看答案及解析
-
下列根据实验操作和现象所得出的结论正确的是
选项 实验操作 实验现象 结论
A 取等物质的量的两种金属单质X、Y,分别与足量的盐酸反应 X产生氢气的体积比Y多 金属性:X>Y
B 向滴有甲基橙的AgNO3溶液中滴加KCl溶液 溶液由红色变为黄色 KCl溶液具有碱性
C 在CuSO4溶液中加入KI溶液,再加入苯,振荡 有白色沉淀生成,苯层呈紫色 白色沉淀可能为CuI
D 取久置的Na2O2粉末,向其中滴加过量的盐酸 产生无色气体 Na2O2没有变质
难度: 中等查看答案及解析
-
在体积为2 L的恒容密闭容器中发生反应xA(g)+yB(g)
zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是
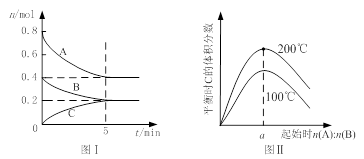
A.200℃时,反应从开始到平衡的平均速率v(B)= 0. 02 mol·L-1·min-1
B.图Ⅱ所知反应xA(g)+yB(g)
zC(g)的△H<0,且a=2
C.若在图Ⅰ所示的平衡状态下,再向体系中充入He,重新达到平衡前v(正)>v(逆)
D.200℃时,向容器中充入2 mol A 和1 mol B,达到平衡时,A 的体积分数小于0.5
难度: 困难查看答案及解析
-
25℃时,0.1 mol Na2CO3与盐酸混合所得的一组体积为1 L的溶液,溶液中部分微粒与pH 的关系如图所示。下列有关溶液中离子浓度关系叙述正确的是
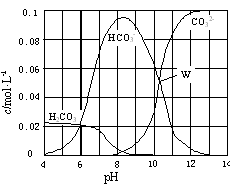
A.W点所示的溶液中:c(Na+)+ c(H+)=2c(CO32-)+ c(OH-)+ c(Cl-)
B.pH=4的溶液中:c(H2CO3)+ c(HCO3-)+ c(CO32-)<0.1 mol·L-1
C.pH=8的溶液中:c(H+)+ c(H2CO3)+ c(HCO3-) = c(OH-)+c(Cl-)
D.pH=11的溶液中:c(Na+)>c(Cl-)>c(CO32-)>c(HCO3-)>c(H2CO3)
难度: 困难查看答案及解析