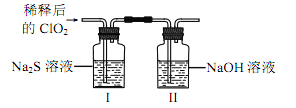
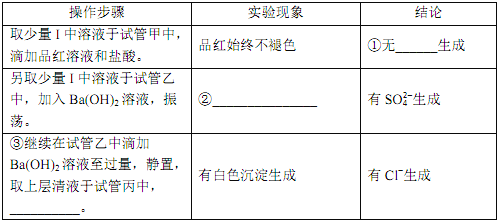
-
用NA表示阿伏加德罗常数的值,下列叙述中正确的是
A. 常温下,1L0.1 mol•L-1CH3COONa溶液中CH3COO-离子数目为0.1NA
B. 标准状况下,11.2LHF 含有0.5 NAHF分子
C. 将含0.1mol FeCl3的饱和溶液滴入沸水形成的胶体粒子的数目小于0.1 NA
D. 含19.6gH2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1 NA
难度: 中等查看答案及解析
-
下列说法正确的是
A. 在25℃、101KPa,1mol S(s)和2molS(s) 的燃烧热相等
B. 1mol H2SO4 (浓)与1mol Ba(OH)2完全中和所放出的热量为中和热
C. CO是不稳定的氧化物,它能继续和氧气反应生成稳定的CO2 ,所以CO的燃烧反应一定是吸热反应
D. 101KPa时,1mol H2燃烧所放出的热量为氢气的燃烧热
难度: 中等查看答案及解析
-
盛有O2和NO2的混合气体的量筒倒立在盛有水的水槽中,过一段时间后,量筒内的气体体积减小为原来的一半。则原混合气体中O2和NO2的体积比是( )
A. 2∶1 B. 1∶2 C. 3∶2 D. 3∶1
难度: 中等查看答案及解析
-
被称之为“软电池”的纸质电池,采用一个薄层纸片作为传导体,在其一边镀锌,而在其另一边镀二氧化锰。在纸内的离子“流过”水和氧化锌组成的电解液。电池总反应为Zn+2MnO2+H2O = ZnO+2MnO(OH)。下列说法正确的是
A. 该电池的正极为锌
B. 该电池反应中二氧化锰起催化剂作用
C. 当0.1 mol Zn完全溶解时,流经电解液的电子个数为1.204×1023
D. 电池负极反应式为Zn - 2e-+2OH- = ZnO+H2O
难度: 中等查看答案及解析
-
通过实验、观察、类比、推理等方法得出正确的结论是化学学习的方法之一。对下列反应的推断或解释正确的是( )
选项
操作
可能的实验现象
解释
A
向FeCl2溶液中滴入用硫酸酸化的H2O2溶液
溶液变黄
发生氧化还原反应,且氧化性:H2O2>Fe3+
B
将CO2 通入Ba(NO3)2溶液中
有白色沉淀生成
CO2与Ba(NO3)2反应生成BaCO3
C
某溶液中加入硝酸酸化的氯化钡溶液
有白色沉淀生成
溶液中一定含有SO42-
D
向淀粉-KI溶液中通入少量Cl2
溶液变蓝
Cl2与淀粉发生显色反应
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
已知:2C(s)+O2(g)=2CO(g)ΔH=-217kJ·mol-1
C(s)+H2O(g)=CO(g)+H2(g) ΔH=b kJ·mol-1
H-H、O-H和O=O键的键能分别为436、462和495kJ·mol-1,则b为
A. +352 B. +132 C. -120 D. -330
难度: 简单查看答案及解析
-
下列化学用语表示正确的是
A. Mg2+的结构示意图:
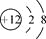 B. 葡萄糖的结构简式:C6H12O6
B. 葡萄糖的结构简式:C6H12O6C. H2O2的电子式:
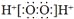 D. 硫酸的电离方程式:H2SO4=H22++ SO42-
D. 硫酸的电离方程式:H2SO4=H22++ SO42-难度: 中等查看答案及解析
-
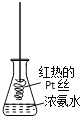
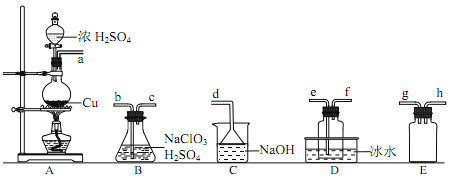
利用下列实验装置可以达到实验目的的是


A. 甲装置可以实现Cl2的制取、收集、尾气吸收
B. 乙装置可以实现乙酸乙酯的制取和收集
C. 丙装置可以形成Cu—Zn原电池
D. 丁装置可证明H2CO3的酸性大于H2SiO3
难度: 中等查看答案及解析
-
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42﹣等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示.下列有关对该溶液的判断不正确的是
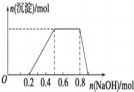
A. 该溶液中肯定含有的离子是H+、NH4+、Al3+、SO42﹣
B. 肯定不含的阳离子是Mg2+、Fe3+
C. 要确定该溶液是否含有Na+,必须做焰色反应实验,看焰色是否为黄色
D. 该溶液中肯定含有的离子的物质的量之比为n(H+):n(NH4+):n(Al3+):n(SO42﹣)=2:3:1:4
难度: 困难查看答案及解析
-
X、Y、Z、M、Q、R皆为前20号元素,其原子半径与主要化合价的关系如图所示。下列说法错误是

A. Q位于第三周期IA族
B. X、Y、Z三种元素组成的化合物可能是盐或碱
C. 简单离子半径:M->Q+>R2+
D. Z与M的最高价氧化物对应水化物均为强酸
难度: 困难查看答案及解析
-
下列酸性H2CO3>HClO>HCO3—,下列有关叙述中正确的是
①向NaClO溶液中通入少量二氧化碳的离子反应方程式为:2ClO—+CO2+H2O=2HC1O+CO32—
②向KI和KBr混合溶液中,加入足量FeCl3溶液,用CCl4萃取后取上层中的液体少许并加入AgNO3溶液,有淡黄色沉淀生成
③向FeI2溶液中滴加少量氯水。反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl—
④卫生间的洁厕灵不能跟84消毒液混用,其离子方程式为:ClO—+Cl—+2H+=Cl2↑+H2O
A.②④ B.①③ C.②③ D.①④
难度: 中等查看答案及解析
-
将稀硫酸和稀硝酸的混合酸加入足量的铜粉,HNO 3的物质的量浓度是2mol﹒L —1,取10mL此混合酸,待反应结束过滤后可得到纯净的CuSO 4溶液,则上述稀硫酸的物质的量浓度和在标准状况下产生的气体体积分别为(设反应中HNO 3被还原成NO)
A. 2mol﹒L—1、448mL B. 3mol﹒L—1、672mL
C. 4mol﹒L—1、224mL D. 3mol﹒L—1、448mL
难度: 困难查看答案及解析
-
交通运输部在南海华阳礁举行华阳灯塔和赤瓜灯塔竣工发光仪式,宣布两座大型多功能灯塔正式发光并投入使用。镁海水电池可为灯塔提供能源,其装置如图所示。下列有关镁海水电池的说法正确的是

A. Mg电极上发生还原反应
B. 该电池工作一段时间后,左侧溶液质量减轻
C. 正极的电极反应式为H2O2+2e-+2H+=2H2O
D. 若电池工作时转移2mol 电子,则有2molH+由质子交换膜左侧向右侧迁移
难度: 中等查看答案及解析
-
随着各地治霾力度的加大,大力发展高性能燃料电池汽车成为研究课题。如图是某课题组设计的液体燃料电池示意图。下列有关叙述不正确的是
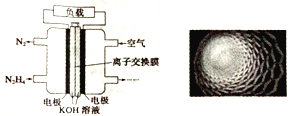
A. 该电池的优点是不产生污染气体,且液体燃料便于携带
B. 电池内部使用的是阴离子交换膜,OH-经交换膜移向负极
C. 该燃料电池的电极材料采用多孔纳米碳材料(如图),目的是增大接触面积,增加吸附量
D. 该电池中通入N2H4的电极为正极,发生的电极反应式为N2H4+4OH--4e-=N2↑+4H2O
难度: 困难查看答案及解析
-
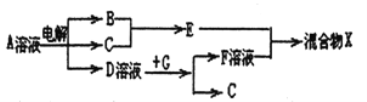
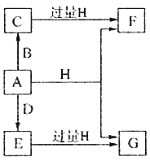
向59.2 g Fe2O3和FeO的混合物中加入某浓度的稀硝酸1.0 L,固体物质完全反应,生成NO和Fe(NO3)3。在所得溶液中加入1.0 mol/L的NaOH溶液2.8 L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为85.6g。下列有关说法错误的是
A. Fe2O3与FeO的物质的量之比为1∶6
B. 硝酸的物质的量浓度为3.0 mol/L
C. 产生的NO在标准状况下的体积为4.48 L
D. Fe2O3、FeO与硝酸反应后剩余HNO3为0.2 mol
难度: 困难查看答案及解析