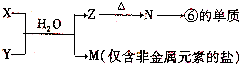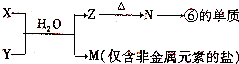-
下表为元素周期表的一部分。请参照元素①~⑧在表中的位置,回答下列问题:
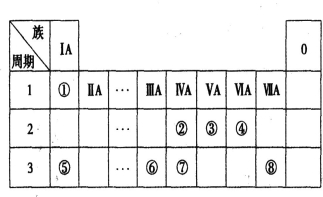
(1)④⑤⑥的原子半径由小到大的顺序为(用元素符号表示) 。
②③⑦的最高价含氧酸的酸性由弱到强的顺序是(用化学式表示) 。
(2)④与⑤常温下可发生反应生成化合物A,请用电子式表示A的形成过程______________。
(3)由表中元素①③④⑥⑧所形成的常见物质X、Y、Z、M、N可发生以下反应:
①X溶液与Y溶液反应的离子方程式为 ;
②由N制取⑥对应的单质所采用的方法是 ;
③M溶液呈酸性,原因是(用离子方程式解释) 。
-
下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
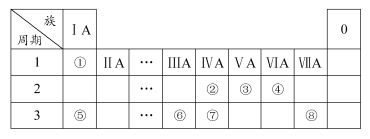
(1)④⑤⑥的原子半径由小到大的顺序为(用元素符号表示) ;
②③⑦的最高价含氧酸的酸性由弱到强的顺序是(用化学式表示) 。
(2)写出由以上某些元素构成的既含离子键、又含极性共价键的化合物的电子式(写出一种即可) 。
(3)已知常温下1 g①单质在④单质中燃烧生成稳定的液态物质时放出142.9 kJ热量,则表示①单质燃烧的热化学方程式为 。
(4)①②形成的最简单的化合物与④单质在KOH作电解质溶液时可形成原电池,其中负极的电极反应为 。
(5)由表中元素①③④⑥⑧所形成的常见物质X、Y、Z、M、N可发生以下反应:

①X溶液与Y溶液反应的离子方程式为 ;
②N→⑥的单质所采用的方法是 ;
③M溶液呈酸性,原因是(用离子方程式解释) 。
-
下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
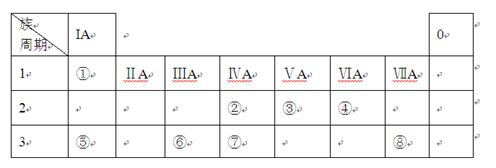
(1)⑤、⑥、⑦元素的原子半径由大到小的顺序为 。
(2)②、③、⑦元素的最高价含氧酸的酸性由强到弱的顺序是________。
(3)由表中两种元素的原子按1︰1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)________ 。
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
(4)元素⑥的氯化物溶液与稀氨水溶液反应的离子方程式 。
工业上冶炼单质⑥的反应原理 。
(5)某无色稀溶液X含有四种阴离子,是由②④⑥⑦⑧元素中的一种或两种组成。现取该溶液适量,向其中加入稀盐酸,产生沉淀的物质的量(n)与加入试剂体积(V)的关系如图所示。
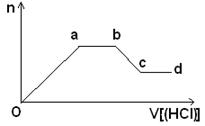
则oa段转化为沉淀的离子(指来源于X溶液,下同)是________,ab段发生反应的离子是________,bc段发生反应的离子方程式为_____________________________________。
-
下表为元素周期表的一部分,参照元素①~⑦在表中的位置,请用化学用语回答下列
问题:
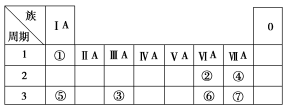
(1)④、⑤、⑦的原子半径由大到小的顺序为 (用元素符号表示,下同)。
(2)⑥和⑦的最高价含氧酸的酸性强弱为 > 。
(3)①、②两种元素按原子个数之比为1∶1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式 。
(4)由表中元素形成的物质可发生如图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。
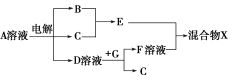
①写出D溶液与G反应的化学方程式 。
②写出检验A溶液中溶质的阴离子的方法: 。
③常温下,若电解1 L 0.1 mol/L的A溶液,一段时间后测得溶液pH为12(忽略溶液体积变化),则该电解过程中转移电子的物质的量为 mol。
④若上图中各步反应均为恰好完全转化,则混合物X中含有的物质有 。
-
下表为元素周期表的一部分,参照元素①~⑦在表中的位置,请用化学用语回答下列问题:

(1)④、⑤、⑦的原子半径由大到小的顺序为 (用元素符号表示,下同)。
(2)⑥和⑦的最高价含氧酸的酸性强弱为 > 。
(3)①、②两种元素按原子个数之比为1∶1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式 。
(4)由表中元素形成的物质可发生如图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。
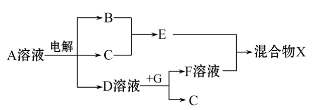
①写出D溶液与G反应的化学方程式 。
②写出检验A溶液中溶质的阴离子的方法: 。
③常温下,若电解1 L 0.1 mol/L的A溶液,一段时间后测得溶液pH为12(忽略溶液体积变化),则该电解过程中转移电子的物质的量为 mol。
④若上图中各步反应均为恰好完全转化,则混合物X中含有的物质有 。
-
下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:
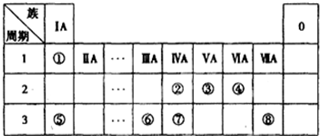
(1)④⑤⑥的原子半径由小到大的顺序为(用元素符号表示)______.
②③⑦的最高价含氧酸的酸性由弱到强的顺序是(用化学式表示)______.
(2)写出由以上某些元素构成的既含离子键、又含极性共价键的化合物的电子式(写出一种即可)______.
(3)已知常温下1g ①单质在④单质中燃烧生成稳定的液态物质时放出142.9kJ热量,则表示①单质燃烧热的热化学方程式为______.
(4)①②形成的最简单的化合物与④单质在KOH作电解液时可形成原电池,其中负极的电极反应为______.
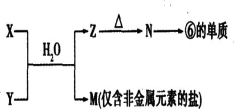
(5)由表中元素①③④⑥⑧所形成的常见物质X、Y、Z、M、N可发生以下反应:
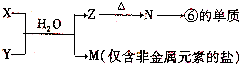
①X溶液与Y溶液反应的离子方程式为______;
②N→⑥的单质所采用的方法是______;
③M溶液呈酸性,原因是(用离子方程式解释)______.
-
下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:
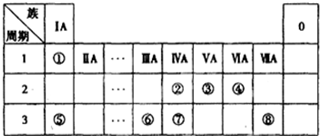
(1)④⑤⑥的原子半径由小到大的顺序为(用元素符号表示)______.
②③⑦的最高价含氧酸的酸性由弱到强的顺序是(用化学式表示)______.
(2)写出由以上某些元素构成的既含离子键、又含极性共价键的化合物的电子式(写出一种即可)______.
(3)已知常温下1g ①单质在④单质中燃烧生成稳定的液态物质时放出142.9kJ热量,则表示①单质燃烧热的热化学方程式为______.
(4)①②形成的最简单的化合物与④单质在KOH作电解液时可形成原电池,其中负极的电极反应为______.
(5)由表中元素①③④⑥⑧所形成的常见物质X、Y、Z、M、N可发生以下反应:
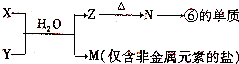
①X溶液与Y溶液反应的离子方程式为______;
②N→⑥的单质所采用的方法是______;
③M溶液呈酸性,原因是(用离子方程式解释)______.
-
(10分)如表所示为元素周期表的一部分,参照元素①~⑦在表中的位置,请回答下列问题:

(1)③、④、⑦的原子半径由大到小的顺序为(用元素符号表示,下同) ;
(2)⑥和⑦的最高价含氧酸的酸性强弱为(用酸的化学式表示) ;
(3)①、②两种元素按原子个数之比为1:1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式 ;
(4)由表中元素形成的物质可发生如图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。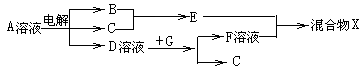
①写出D溶液与G反应的化学方程式: ;
②写出检验A溶液中溶质的阴离子的方法: ;
③常温下,若电解1L0.1mol/L的A溶液,一段时间后测得溶液pH为12(忽略溶液体积变化),则该电解过程中转移电子的物质的量为: ;
④若上图中各步反应均为恰好完全转化,则混合物X中含有的物质有: 。
-
如图所示为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:
(1)④⑤⑥的原子半径由大到小的顺序是______(填元素序号).
(2)②③⑦的最高价含氧酸的酸性由强到弱的顺序是______(填化学式).
(3)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为______(填序号).
a.MnO2
b.FeCl3
c.Na2SO3
d.KMnO4
(4)由表中元素组成的常见物质x、Y、Z、M、N可发生以下反应:
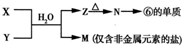
X溶液与Y溶液反应的离子方程式为______.
N→⑥的单质的化学方程式为______ 4Al+3O2↑
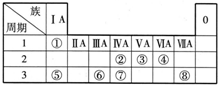
-
如表所示为元素周期表的一部分,参照元素①~⑨在表中的位置,请回答下列问题:
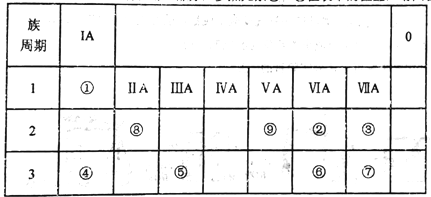
(1)③、④、⑦的原子半径由大到小的顺序是___________(用元素符号表示)。
(2)下列事实能说明②元素的非金属性比⑥元素的非金属性强的是_______。
A.②的单质与⑥元素的简单氢化物溶液反应,溶液变浑浊
B.在氧化还原反应中,1mol②单质比lmo1⑥单质得电子多
C.②和⑥两元素的简单氢化物受热分解,前者的分解温度高。
(3)①、②两种元素按原子个数之比为1:1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式____________________。
(4)已知周期表中存在对角相似规则,如铍(Be)与铝化学性质相似,⑧的氧化物、氢氧化物也有两性,写出⑧的氢氧化物与④的最高价氧化物的水化物反应的化学方程式_____________。
(5)已知W+X=Y+Z (反应需要加热,),W、X、Y、Z分别是由①②⑨三种元素形成的四种10电子粒子(W、X为离子,Y、Z为分子),写出该化学方程式______________。
(6)由表中元素形成的物质可发生如图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。
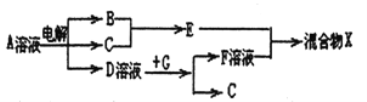
①写出D溶液与G反应的离子方程式_______________。
②写出检验A溶液中溶质的阴离子的方法_______________。