-
下列物质不属于合金的是( )
A. 金刚石 B. 硬铝 C. 不锈钢 D. 青铜
难度: 简单查看答案及解析
-
下列元素非金属性最强的是( )
A. 硅 B. 磷 C. 硫 D. 砷
难度: 简单查看答案及解析
-
能使溴水褪色的是( )
A. 乙烯 B. 乙烷 C. 乙醇 D. 乙酸
难度: 简单查看答案及解析
-
下列物质中含有离子的是( )
A. 晶体硅 B. 冰醋酸 C. 液态氯化氢 D. 铝粉
难度: 简单查看答案及解析
-
某烃经催化加氢后可得到2-甲基丁烷,则该烃的名称不可能是( )
A. 2-甲基-1-丁烯 B. 2-甲基-2-丁烯 C. 2-甲基-2-丁炔 D. 3-甲基-1-丁炔
难度: 中等查看答案及解析
-
影响1 mol 气体体积大小的主要因素是( )
A. 分子大小 B. 分子质量 C. 分子内键长 D. 分子间距离
难度: 简单查看答案及解析
-
实验室除去硝基苯中的氮氧化物杂质时用不到的仪器是( )
A. 漏斗 B. 分液漏斗 C. 烧杯 D. 铁架台
难度: 简单查看答案及解析
-
下列各组物质的熔沸点能用化学键的强弱解释的是( )
A. H2O > H2S B. NaCl > O2 C. Na > K D. SiO2 > CO2
难度: 中等查看答案及解析
-
有关碳元素及其化合物的化学用语正确的是( )
A. 碳——12 原子:
B. C原子最外层电子的轨道表示式:
C. 醋酸钠的分子式:C2H3O2Na
D. 2-甲基-1-丙醇的结构简式:
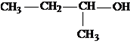
难度: 中等查看答案及解析
-
密闭容器中可逆反应
达到平衡后,若增大压强,下列说法不正确的是( )
A. 混合气体颜色变浅 B. 逆反应速率加快
C. NO2转化率增大 D. 气体平均分子量变大
难度: 中等查看答案及解析
-
下列实验合理的是( )
A. 用溴水除去NaCl溶液中的Nal
B. 用NaOH溶液与HCl溶液制备NaCl
C. 用NaOH溶液除去乙酸乙酯中的溴
D. 用冷却热饱和溶液法提纯含少量NaCl杂质的KNO3
难度: 中等查看答案及解析
-
某有机物结构如图所示,有关该物质的叙述正确的是( )
A. 易溶于水
B. 一氯代物有5种
C. 最多能与氢气以物质的量之比1:4加成
D. 碱性水解的产物之一是1-丙醇
难度: 中等查看答案及解析
-
在水电离出来的
的溶液中一定不能大量共存的离子组是( )
A. NH4+、
、
、NO3- B.
、
、SO32-、
C.
、
、AlO2-、SO42- D.
、
、NO3-、
难度: 困难查看答案及解析
-
如图用石墨电极电解CuCl2溶液。下列分析不正确的是( )
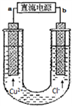
A. a端是直流电源的负极
B. 通电使CuCl2发生电离
C. 阴极上发生的反应:
D. 通电后,在阳极附近可观察到黄绿色气体
难度: 中等查看答案及解析
-
有盐酸和醋酸两种溶液,
,下列叙述正确的是( )
A. 醋酸溶液的pH大于盐酸
B. 醋酸溶液的pH小于盐酸
C. 分别用水稀释相同倍数后,所得溶液中:
D. 两种溶液中水的电离程度相同
难度: 困难查看答案及解析
-
X、Y均为元素周期表中前20号元素,其简单离子的电子层结构相同,下列说法正确的是( )
A. 由
与
得,m+b=n+a
B.
的还原性一定大于
C. X、Y一定是同周期元素
D. 若X的原子半径大于Y,则X的氢化物稳定性一定大于Y的氢化物
难度: 困难查看答案及解析
-
已知还原性
,某溶液中可能含有
、
、
、
,向该无色溶液中加入少量溴水,溶液仍无色。则下列关于该溶液组成的判断正确的是( )
A. 肯定不含
B. 可能不含
C. 可能含有
D. 以上结论都不对
难度: 困难查看答案及解析
-
现将6.96g 的
与100g 35.6%的盐酸(盐酸足量)共热,向反应后的溶液中加水稀释到250mL,取25mL跟足量的
溶液反应。若不考虑HCl的挥发,下列说法正确的是( )
A. 产生氯气1.792L B. 生成AgCl沉淀11.7g
C. 被还原的HCl为0.16mol D. 转移的电子数为0.16个
难度: 困难查看答案及解析


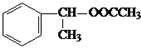 ,写出合成路线图_________________。
,写出合成路线图_________________。