-
下列说法中,正确的是
A.离子化合物中一定不含共价键,共价化合物中一定不含离子键
B.水分子呈直线形,氨分子呈三角锥形
C.碳原子之间可形成碳碳单键、碳碳双键或碳碳叁键
D.分子间作用力越大,分子的热稳定性就越大
难度: 中等查看答案及解析
-
下列说法正确的是
A.蛋白质、纤维、蔗糖、聚乙烯、淀粉都是高分子化合物
B.研制乙醇汽油(汽油中添加一定比例的乙醇)技术,可以降低机动车辆尾气中有害气体排放
C.使用太阳能热水器、沼气的利用、玉米制乙醇都涉及到生物质能的利用
D.石油、煤、天然气、可燃冰、植物油都属于化石燃料
难度: 中等查看答案及解析
-
正确掌握化学用语是学好化学的基础。下列化学用语中正确的是
A.乙烯的结构简式为CH2CH2 B.羟基的电子式:
C.Ca2+的结构示意图为
D .乙醇的分子式:CH3CH2OH
难度: 中等查看答案及解析
-
下列过程属于物理变化的是
A. 由乙烯变为聚乙烯 B.蛋白质盐析
C.O2转变为O3 D.皂化反应
难度: 中等查看答案及解析
-
某元素R的核内含有N个中子,R的质量数为A,在其与氢化合时,R呈-n价,则WgR的气态氢化物中所含电子的物质的量为
A.
B.
C.
D.
难度: 中等查看答案及解析
-
下列性质的递变规律不正确的是
A.NaOH、KOH、CsOH碱性依次增强
B.Li、Na、K、Rb、Cs单质的失电子能力逐渐增强
C.Al、Mg、Na的原子半径依次减小
D.HCl、H2S、PH3稳定性依次减弱
难度: 中等查看答案及解析
-
下列各组物质,化学键类型相同、晶体类型也相同的是
A.SO2和
B.CO2和H2S C.NaCl和HCl D.CCl4和KCl
难度: 中等查看答案及解析
-
在5 mL 0.1 mol·L-1KI溶液中滴加0.1 mol·L-1FeCl3溶液5~6滴后,再进行下列实验,其中可证明FeCl3溶液和KI溶液的反应是可逆反应的实验是
A.再滴加AgNO3溶液,观察是否有AgI沉淀产生
B. 加入CCl4振荡后,观察下层液体颜色
C.加入CCl4振荡后,取上层清液,滴加AgNO3溶液,观察是否有AgCl沉淀产生
D.加入CCl4振荡后,取上层清液,滴加KSCN溶液,观察是否有血红色
难度: 中等查看答案及解析
-
对于锌、铜和稀硫酸组成的原电池(如图),下列有关说法不正确的是
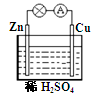
A.Zn是负极 B.电子由Zn经外电路流向Cu
C.溶液中H+ 向负极移动 D.Zn电极反应:Zn -2e-==Zn2+
难度: 中等查看答案及解析
-
某有机物的结构为
, 这种有机物不可能具有的性质是
A.能使酸性KMnO4溶液褪色 B.能发生酯化反应
C.能发生水解反应 D.能跟NaOH溶液反应
难度: 中等查看答案及解析
-
下列对有机物结构的叙述中不正确的是
A.硝基、羟基、氯原子、苯环、甲基都是官能团
B.邻二氯苯不存在同分异构体说明苯分子中6个碳原子之间的键是完全一样的
C.乙烯、苯分子中所有原子共平面
D.CH2Cl2只有一种结构说明甲烷分子是正四面体结构,而不是平面正方形结构
难度: 中等查看答案及解析
-
砷为第4周期第ⅤA族元素,根据它在元素周期表中的位置推测,砷不可能具有的性质是
A.砷在通常情况下是固体 B.可以存在-3、+3、+5等多种化合价
C.As2O5对应水化物的酸性比H3PO4弱 D.砷的还原性比磷弱
难度: 中等查看答案及解析
-
一定温度下, 将 3 mol SO2 和 1 mol O2 充入一定容密闭容器中, 在催化剂存在下进行下列反应: 2SO2(g) + O2(g)
2SO3(g); △H= -197 kJ/ mol, 当达到平衡状态时, 下列说法中正确的是
A.生成 SO3 为2 mol
B.放出 197 kJ 的热量
C.SO2 和 SO3 物质的量之和一定为 3 mol
D.SO2 的物质的量和SO3 物质的量一定相等
难度: 中等查看答案及解析
-
在20世纪末期,科学家发现并证明碳有新的单质形态C60存在。后来人们又相继得到了C70、C76、C84、C90、C94等另外一些球碳分子。21世纪初,科学家又发现了管状碳分子和洋葱状碳分子,大大丰富了碳元素单质的家族。
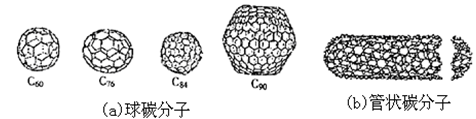
下列有关碳元素单质的说法错误的是
A.金刚石的熔点肯定要比C60高
B.金刚石的硬度肯定要比C60大
C.球碳分子,管状碳分子、洋葱状碳分子,都是分子晶体,都是碳的同素异形体
D.金刚石属原子晶体,管状碳分子属分子晶体,它们不是同素异形体。
难度: 中等查看答案及解析
-
某烃的分子式中含有一个苯环,两个
和一个—C≡C—,则它的分子式可能为
A.C9H12 B.C17H20 C.C20H30 D.C12H20
难度: 中等查看答案及解析
-
能正确表示下列化学反应的离子方程式的是
A.金属钾投入水中 K + H2O = K+ + OH—+ H2↑
B.湿法炼铜 Fe3+ + Cu = Fe2++ Cu2+
C.用食醋除水垢 CaCO3 + 2H+ = Ca2+ + CO2↑+ H2O
D.电解饱和食盐水 2Cl—+ 2H2O
H2 ↑+ Cl2 ↑+ 2OH—
难度: 中等查看答案及解析
-
已知:CH3CH2CH2CH3(g)+6.5O2(g)
4CO2(g)+5H2O(l);DH =-2878 kJ
(CH3)2CHCH3(g)+6.5O2(g)
4CO2(g)+5H2O(l);DH =-2869 kJ
下列说法正确的是
A.异丁烷分子中的碳氢键比正丁烷的多
B.正丁烷分子的能量大于异丁烷分子
C.异丁烷转化为正丁烷的过程是一个放热过程
D.正丁烷的稳定性大于异丁烷
难度: 中等查看答案及解析
-
如图所示烧杯中均盛有海水,铁在其中被腐蚀时由快到慢的顺序是
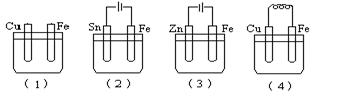
A.(4)(3)(2)(1) B.(4)(2)(1)(3) C.(3)(4)(1)(2) D.(4)(3)(1)(2)
难度: 中等查看答案及解析
-
用下列实验装置完成对应的实验(部分仪器巳省略),能达到实验目的的是

难度: 中等查看答案及解析
-
在绿色化学工艺中,理想状态是反应物中的原子全部转化为欲制得的产物,即原子利用率为100%,在用CH3C≡CH合成CH2=C(CH3)COOCH3的过程中,欲使原子利用率达到最高,还需要其他的反应物有
A.CO2和H2O B.CO和CH3OH C.CH3OH和H2 D.H2和CO2
难度: 中等查看答案及解析