-
下列变化属于吸热反应的是
A.碘的升华
B.Ba(OH)2·8H2O与NH4Cl混合搅拌
C.生石灰与水反应
D.浓硫酸稀释
难度: 中等查看答案及解析
-
下列实验数据合理的是
A.用托盘天平称取11.70g食盐
B.用量筒量取20.00mL未知浓度的盐酸注入锥形瓶
C.用标准NaOH溶液滴定未知浓度的盐酸,用去20.10mL NaOH溶液
D.用广泛pH试纸测某溶液的pH=3.5
难度: 中等查看答案及解析
-
已知:(1)Zn(s) + 1/2O2(g) = ZnO(s);ΔH =-348.3 kJ·mol-1
(2)2Ag(s) + 1/2O2(g) = Ag2O(s);ΔH =-31.0 kJ·mol-1
则Zn(s) + Ag2O(s) = ZnO(s) + 2Ag(s)的ΔH等于
A.-317.3 kJ·mol-1
B.-379.3 kJ·mol-1
C.+317.3 kJ·mol-1
D.+379.3 kJ·mol-1
难度: 简单查看答案及解析
-
下列各项判断完全正确的是
变化
△H
△S
方向性
A.H2O(l)→H2O(g)
>0
<0
非自发
B.2NO2(g)
N2O4(g)
<0
<0
自发
C.2Fe3+(aq) + Cu(s) = 2Fe2+(aq) + Cu2+(aq)
>0
>0
自发
D.NH4Cl(s) = NH3(g) + HCl(g)
<0
>0
非自发
难度: 中等查看答案及解析
-
已知:X2(g)+Y2(g)
2Z(g),X2、Y2、Z的起始浓度分别为0.1mol·L-1、0.3 mol·L-1、0.2 mol·L-1。在一定条件下,当反应达到平衡时,各物质的浓度可能是
A.Z为0.4mol·L-1
B.X2为0.2 mol·L-1
C.Y2为0.4 mol·L-1
D.Z为0.3 mol·L-1
难度: 简单查看答案及解析
-
0.1 mol·L-1的下列溶液:①HCl ②H2SO4 ③CH3COOH ④NaOH,水的电离程度由大到小
的顺序正确的是
A.③>①>②>④ B.④>③>①>② C.③>①=④>② D.①=③=④>②
难度: 中等查看答案及解析
-
室温下等体积的酸和碱混合,混合溶液的pH一定等于7的是
A.pH=3的盐酸和pH=11的氨水
B.pH=3的硝酸和pH=11的Ba(OH)2溶液
C.pH=3的硫酸和pH=11的氨水
D.pH=3的醋酸和pH=11的Ba(OH)2溶液
难度: 简单查看答案及解析
-
将等物质的量的X和Y混合气体,通入密闭容器中发生如下反应:X(g)+2Y(g)
2Z(g),平衡时混合气体中反应物的总物质的量与生成物的总物质的量之比为3:2,则Y的转化率最接近于
A.33% B.40% C.50% D.67%
难度: 简单查看答案及解析
-
下列说法正确的是
A.改变条件使平衡正移,反应物的转化率一定增大
B.pH=1的醋酸加水稀释,溶液中各离子浓度都减小
C.合成氨反应等温压缩,重新建立平衡时各组分浓度都增大
D.pH均为2的盐酸和醋酸分别加水稀释至原来的10倍,水的电离程度相等
难度: 中等查看答案及解析
-
室温下,下列各组微粒在指定的分散系中一定能大量共存的是
A.pH=13的溶液:Na+、Ba2+、NH3、Cl-
B.由水电离的c(H+)=1×10-14mol·L-1的溶液:K+、Ca2+、Cl-、HCO3-
C.Al(OH)3胶体:Na+、K+、Cl-、SO42-
D.使甲基橙呈红色的溶液:Na+、Fe2+、SO42-、NO3-
难度: 中等查看答案及解析
-
下列溶液一定呈中性的是
A.c(H+) = 1×10-7mol·L-1的溶液
B.pH=pOH 的溶液
C.pH=14-pOH 的溶液
D.浓度均为0.1 mol·L-1的一元酸与氢氧化钠溶液等体积混合
难度: 中等查看答案及解析
-
某温度下,向2L的密闭容器中加入1molX和2molY:X(g) + mY(g)
3Z(g),平衡时X、Y、Z的体积分数分别为30%、60%、10%。向平衡体系中再加入1molZ,重新建立平衡时X、Y、Z的体积分数不变。下列叙述不正确的是
A.m = 2 B.X与Y的转化率相等
C.该温度下的平衡常数约为9.3×10-3 D.重新建立平衡时Z的浓度为0.4mol·L-1
难度: 中等查看答案及解析
-
下列情况下平衡一定发生移动的是
A.混合物中各组分的浓度改变 B.正、逆反应速率改变
C.平衡体系的温度改变 D.混合气体的压强改变
难度: 中等查看答案及解析
-
恒温恒容的密闭容器中发生如下反应:2A(g) +B(s)
C(g) +D(g),当下列物理量不再发生变化时:①混合气体的密度 ②容器内气体的压强 ③混合气体的平均相对分子质量 ④C的物质的量浓度,上述反应一定达到平衡状态的是
A.②③ B.②④ C.②③④ D.①③④
难度: 中等查看答案及解析
-
室温下用0.10 mol·L-1的NaOH溶液滴定20.00mL未知浓度的CH3COOH,滴定终点消耗20.00mL的NaOH溶液。下列说法正确的是
A.滴定终点时溶液由无色变为浅红色且保持半分钟颜色不变
B.滴定终点时混合溶液的pH=7
C.滴定终点时反应的热效应即为中和热
D.滴定终点时两者恰好完全反应
难度: 中等查看答案及解析
-
常温下,向体积均为V0、浓度均为c mol·L-1的MOH和ROH溶液中分别加水稀释至体积为V,溶液pH随
的变化如图所示。下列叙述正确的是
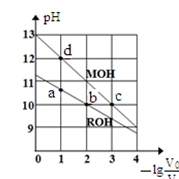
A.碱性:MOH>ROH
B.b、c两点的溶液中:c(R+)>c(M+)
C.溶液中水的的电离程度α:αc>αb>αa>αd
D.c>0.1
难度: 中等查看答案及解析
-
向某密闭容器中加入0.3mol A、0.1mol C和一定量B的混合气体,在一定条件下发生反应,各物质的浓度随时间变化如图甲所示(t0~t1阶段的c(B)变化未画出),图乙为t2时刻改变条件平衡体系中正、逆反应速率随时间变化的情况,且四个阶段各改变一种不同的反应条件。下列说法中正确的是
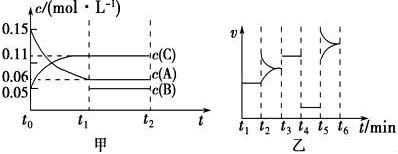
A.若t1=15 s,t0~t1阶段B的平均反应速率为0.004 mol·L-1·s-1
B.t4~t5阶段改变的条件是减小压强
C.该容器的容积为2 L,B的起始物质的量为0.02 mol
D.t5~t6阶段,容器内A的物质的量减少了0.06 mol,容器与外界的热交换为a kJ,则该反应的热化学方程式为3A(g)
B(g)+2C(g) △H=-50a kJ·mol-1
难度: 困难查看答案及解析
-
已知甲、乙中进行的反应是:N2(g)+3H2(g)
2NH3(g);丙、丁中进行的反应是:H2(g)+I2(g)
2HI(g) ∆H=-akJ·mol-1。实验条件和起始投料如下表所示,下列说法正确的是
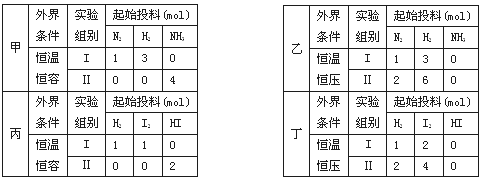
A.甲组中,若平衡时N2和NH3的转化率分别为α1 和α2,则α1 + α2 = 1
B.乙组中,平衡Ⅱ中NH3的浓度是平衡Ⅰ的二倍
C.丙组中,若平衡时Ⅰ中放热Q1kJ, Ⅱ中吸热Q2kJ,则Q1 + Q2 = a
D.丁组中,建立平衡的时间:tⅠ<tⅡ
难度: 困难查看答案及解析