-
化学与科学、技术、社会、环境密切相关。下列说法不正确的是( )
A.含有食品添加剂的物质均对人体健康有害
B.聚乙烯是无毒高分子化合物,可用作食品包装
C.“地沟油”经过加工处理后,可以用来制肥皂和生物柴油
D.太阳能电池板中有高纯硅单质,光导纤维的主要成分是二氧化硅
难度: 简单查看答案及解析
-
已知A、B、C、D、E是短周期原子序数依次增大的五种元素,A原子在元素周期表中原子半径最小,B与E同主族,且E的原子序数是B的两倍,C、D是金属,它们的氢氧化物均难溶于水。下列说法不正确的是( )
A.单质D可用于冶炼某些难熔金属
B.工业上常用电解法制得C和D的单质
C.稳定性:A2B>A2E
D.简单离子的半径:C>D>E>B
难度: 简单查看答案及解析
-
NA为阿伏加德罗常数的值,下列叙述中正确的是( )
A.25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH数目为0.2NA
B.100mL 2 mol/L的NaCl溶液中含NaCl分子数为0.2NA
C.常温下,23gNO2和N2O4的混合气体中含有的氮原子数为0.5 NA
D.标准状况下,22.4L过氧化氢中含有的氧原子数为2NA
难度: 中等查看答案及解析
-
下列说法中正确的是( )
① 钠在空气中燃烧生成淡黄色的Na2O2 ② 常温下铝制容器可储运浓硫酸或浓硝酸 ③ 盐酸既有氧化性又有还原性 ④ Fe(OH)3、FeCl2、H2SiO3都不能直接用化合反应制备 ⑤ SO2能使酸性高锰酸钾溶液褪色,所以它具有漂白性
A.②③ B.①②③ C.①②③④ D.①②③⑤
难度: 中等查看答案及解析
-
下列化合物的一氯代物的数目排列顺序正确的是( )
①CH3CH2CH2CH2CH2CH3 ②(CH3)2CHCH(CH3)2
③(CH3)3CCH2CH3 ④(CH3) 3CC(CH3) 3
A.①>②>③>④ B.②>③=①>④
C.③>②>④>① D.③=①>②>④
难度: 中等查看答案及解析
-
常温下,下列溶液中可能大量共存的离子组是( )
A.加入金属镁能产生H2的溶液中: Na+、Fe3+、SO
、NO
B.含有大量Fe2+的溶液中: K+、Mg2+、ClO-、SO
C.能使Al3+生成沉淀的溶液中: NH
、Na+、SiO
、HCO
D.水电离产生的c(OH-)=1×10-10mol/L的溶液中: Al3+、SO
、NO
、Cl-
难度: 中等查看答案及解析
-
下列关于有机物的叙述正确的是( )
A.石油、天然气和煤的主要成分都是烷烃
B.乙烯和苯都能使溴水褪色,故不能用溴水鉴别乙烯和苯蒸气
C.乙醇、乙酸和乙酸乙酯都能发生取代反应和氧化反应
D.棉花与合成纤维的主要成分均为纤维素
难度: 简单查看答案及解析
-
已知:在101 kPa时,1 mol纯物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热,单位为kJ/mol。下列有关热化学方程式的叙述正确的是 ( )
A.已知2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ·mol-1,则氢气的燃烧热为285.8 kJ·mol-1
B.已知C(石墨,s)=C(金刚石,s) △H>0,则金刚石比石墨稳定
C.含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为: NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l)△H=-57.4 kJ/mol
D.己知2C(s)+2O2(g)=2CO2(g)△H1;2C(s)+O2(g)=2CO(g) △H2,则△H1>△H2
难度: 中等查看答案及解析
-
仅用一种试剂鉴别如下物质:苯、CCl4、NaI溶液、NaCl溶液、Na2SO3溶液,下列试剂中不能选用的是 ( )
A.溴水 B.FeCl3溶液 C.酸性KMnO4 溶液 D.AgNO3溶液
难度: 中等查看答案及解析
-
利用下图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产。下列说法中正确的是( )
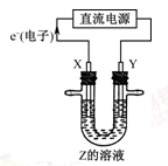
A.氯碱工业中,若X、Y均为石墨,Y附近能得到氯气
B.铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4
C.外加电流的阴极保护法中,Y是待保护金属
D.电镀工业中,X是待镀金属,Y是镀层金属
难度: 中等查看答案及解析
-
常温下已知两种一元弱酸HX和HY,如果向NaX溶液中通CO2 气体,只能生成HX和NaHCO3;往NaY溶液中通入CO2则生成HY和Na2CO3。有关叙述正确的是:( )
A.三种酸的电离常数Ki(HX)> Ki(HY)> Ki(H2CO3)
B.结合H+的能力:Y>CO
>X>HCO
C.溶液碱性:NaX>Na2CO3>NaY>NaHCO3
D.NaX溶液中通入足量CO2后的离子浓度:C(Na+)>c(HCO
)>C(X)>c(OH)>c(H+)
难度: 困难查看答案及解析
-
据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如下图所示。
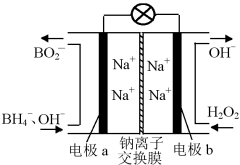
下列说法错误的是( )
A.电池放电时Na+从a极区移向b极区
B.电极b采用MnO2,MnO2既作电极材料又有催化作用
C.该电池的负极反应为:BH
+8OH--8e-=BO
+6H2O
D.每消耗3 mol H2O2,转移的电子为3 mol
难度: 困难查看答案及解析
-
相同温度下,容积相同的甲、乙、丙3个恒容密闭容器中发生可逆反应:2SO2(g)+O2(g)
2SO3(g);
。实验测得起始、平衡时的有关数据如下表:
容器
起始各物质的物质的量/mol
达到平衡时体系能量的变化
SO2
O2
SO3
Ar
甲
2
1
0
0
放出热量:Q1
乙
1.8
0.9
0.2
0
放出热量:Q2
丙
1.8
0.9
0.2
0.1
放出热量:Q3
下列叙述正确的是 ( )
A.Q1=Q2=Q3=197 kJ
B.若在上述条件下反应生成2molSO3(s)的反应热为△H1,则△H1<-197 kJ·mol-1
C.甲、乙、丙3个容器中反应的平衡常数不相等
D.达到平衡时,丙容器中SO2的体积分数最大
难度: 困难查看答案及解析
-
常温下,用0.1000 mol/L NaOH溶液分别滴定20.00 mL 0.1000 mol/L盐酸和20.00 mL 0.1000 mol/L醋酸溶液,得到2条滴定曲线,如下图所示:
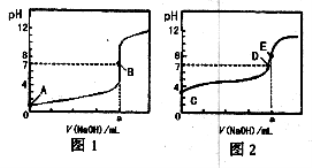
以HA表示酸,下列说法正确的是( )
A.滴定盐酸的曲线是图2
B.达到B、D状态时,两溶液中离子浓度均为c(Na+)=c(A—)
C.达到B、E状态时,反应消耗的n( CH3COOH)>n(HCl)
D.当0mL< V(NaOH)<20.00mL时,对应混合溶液中各离子浓度由大到小的顺序均为c(A-)>c(Na+)>c(H+)>c(OH-)
难度: 困难查看答案及解析