-
化学知识在工农业生产和日常生活中有着重要的应用。下列说法正确的是( )
A.Na2O2、H2O2所含化学键完全相同,都能作供氧剂
B.糖类、蛋白质、油脂、PVC都属于天然高分子化合物
C.常温下,浓硫酸、浓硝酸与铁均能发生钝化,均能用铁罐储运
D.制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料
难度: 中等查看答案及解析
-
下列化学用语表述正确的是( )
A.“84消毒液”中有效成分NaClO的电子式:
B.食盐中阴离子的核外电子排布式:
C.聚丙烯的结构简式:
D.乙烯的结构简式:CH2CH2
难度: 中等查看答案及解析
-
下列说法正确的是( )
①氯水和液氯都能使干燥的有色布条褪色;
②食盐属于盐类,纯碱属于碱类;
③冰和干冰既是纯净物又是化合物;
④青铜和目前流通的1元硬币都是合金;
⑤石油、甘油、豆油都属于油脂。
A.①④ B.③④ C.③⑤ D.②⑤
难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数的值。下列叙述正确的是( )
A.20mL 10 mol/L浓硫酸或浓硝酸与足量铜加热反应转移电子数均为0.2NA
B.0.1mol的白磷(P4)或甲烷中所含的共价键数均为0.4NA
C.标准状况下,2.24LCl2通人足量H2O或NaOH溶液中转移的电子数均为0.1NA
D.在精炼铜或电镀铜的过程中,当阴极析出铜32g转移电子数均为NA
难度: 中等查看答案及解析
-
下表所列各组物质中,不能通过一步反应实现如图所示转化的是( )
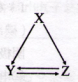
选项 X Y Z
A AlCl3 Al(OH)3 NaAlO2
B C CO CO2
C CH2=CH2 CH3CH2Br CH3CH2OH
D S SO2 SO3
难度: 中等查看答案及解析
-
化学中常用图像直观地描述化学反应的进程或结果。下列图像描述错误的是( )
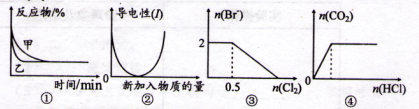
A.图①表示催化剂对可逆反应2X(g)+2Y(g)
3Z(g)+W(s)的影响,乙使用催化剂
B.图②表示乙酸溶液中通人氨气至过量的过程中溶液导电性的变化
C.图③表示在1 L 1 mol·L-1FeBr2溶液中通人C12时Br-的量的变化
D.图④表示一定浓度NaHCO3溶液中滴加盐酸,生成CO2与滴加盐酸物质的量的关系
难度: 中等查看答案及解析
-
下列离子或分子组中能大量共存,且满足相应要求的是( )
选项 离子或分子 要求
A K+、OH-、淀粉、I- 滴加氯水立即变蓝
B Fe2+、NO3-、SO42-、H+ 通C12后加KSCN溶液呈血红色
C Na+、HCO3-、Ca2+、Cl- 滴加NaOH溶液立即有沉淀产生
D K+、NO3-、Cl-、HS- c(K+)<c(HS-)
难度: 中等查看答案及解析
-
下列关于常见有机物的说法中正确的是( )
A.乙烯和苯都能使溴水褪色,褪色的原理相同
B.甲烷与氯气在光照条件下反应可以制取较纯净的一氯甲烷
C.乙烯和乙烷可以用酸性高锰酸钾溶液来鉴别
D.苯分子中含有碳碳双键,所以苯可以和H2发生加成
难度: 中等查看答案及解析
-
下列现象或反应的原理解释正确的是( )
选项 现象或反应 原理解释
A 铝箔在酒精灯火焰上加热熔化但不滴落 铝箔对熔化的铝有较强的吸附作用
B 合成氨反应需在高温条件下进行 该反应为吸热反应
C 镀层破损后,镀锡铁比镀锌铁易腐蚀 锡比锌活泼
D 2CO=2C+O2在任何条件下均不能自发进行 该反应ΔH>0,ΔS<0
难度: 中等查看答案及解析
-
短周期主族元素A、B、C、D原子序数依次递增,A、B、D三种元素既不同周期也不同主族,且原子的最外层电子数之和为13,B与C同周期,C的最外层电子数比B的最外层电子数多1。下列有关说法正确的是( )
A.元素D的单质只能做氧化剂
B.元素B和D可以形成化学式为BD3的共价化合物
C.A、B两种元素形成的化合物的空间构型一定是三角锥形
D.元素A、C不可能形成结构式为A—C—C—A的化合物
难度: 中等查看答案及解析
-
实验是化学研究的基础,关于下列各实验装置图的叙述中,正确的是( )

A.装置甲可用于验证反应的热效应
B.装置乙可定量测定化学反应的速率
C.装置丙可用于实验室以NH4Cl为原料制备少量NH3
D.装置丁a口进气可收集NH3、C12等气体
难度: 中等查看答案及解析
-
下列离子方程式与所述事实相符且正确的是( )
A.Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+H2O
B.明矾溶液中加入过量的Ba(OH)2溶液:Al3++2SO42-+2Ba2++4OH-=A1O2-+2BaSO4+2H2O
C.向硫酸铝溶液中加入过量氨水:Al3++4NH3·H2O=A1O2-+4NH4++2H2O
D.磁性氧化铁溶于稀硝酸:Fe3O4+8H++NO3-=3Fe3++NO↑+4H2O
难度: 中等查看答案及解析
-
高锰酸钾溶液在酸性条件下可以与亚铁离子反应,离子方程式如下(未配平):
________MnO4-+________Fe2++________H+=________Mn2++________Fe3++________H2O
下列有关说法正确的是( )
A.MnO4-和H+是氧化剂,Fe2+是还原剂
B.H2O既是氧化产物又是还原产物
C.每生成1mol水将转移1.2 mol的电子
D.Fe2+的还原性强于Mn2+
难度: 中等查看答案及解析
-
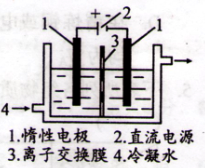
在下图装置中,若通电一段时间后乙装置左侧电极质量增加,则下列说法错误的是( )
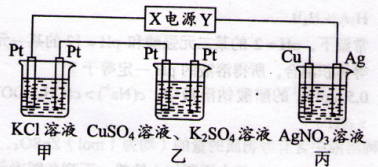
A.乙中左侧电极反应式:Cu2++2e-=Cu
B.电解过程中装置丙的pH无变化
C.向甲中通人适量的HCl气体,可使溶液恢复到电解前的状态
D.当甲装置中产生标准状况下4.48 L气体时,Cu电极上质量增加43.2 g
难度: 中等查看答案及解析
-
一定温度下,在容积为2 L的密闭容器中发生反应CO(g)+H2O(g)
CO2(g)+H2(g),部分数据见下表(表中t2>t1)
反应时间/min
n(CO)/mol
n(H2O)/mol
n(CO2)/mol
n(H2)/mol
0
1.20
0.60
0
0
t1
0.80
t2
0.20
A.反应在t1min末的速率为v(H2)=0.2/t mol·L-1·min-1
B.平衡时水蒸气的转化率为66.67%
C.该温度下反应的平衡常数为l
D.其他条件不变,若起始时,n(CO)=0.60 mol,n(H2O)=1.20 mol,则平衡时水蒸气的转化率为33.33%
难度: 中等查看答案及解析
-
咖啡酸具有止血功效,存在于多种中药中,其结构简式如图:
 ,则下列有关说法正确的是( )
,则下列有关说法正确的是( )A.该物质中苯环上一氯代物有2种
B.1 mol该物质可以与1.5mol碳酸钠溶液反应生成1.5mol的CO2
C.既能发生取代反应,也能发生加成反应
D.所有碳原子不可能都在同一个平面上
难度: 中等查看答案及解析
-
有关电解质溶液的叙述错误的是( )
A.向氨水中加水可使溶液中n(OH-)增大
B.若Na2A、Na2B溶液的pH分别为8和9,则酸性一定是H2A>H2B
C.常温下,pH=2的某二元强酸和pH=12的某一元强碱溶液等体积混合,所得溶液的pH一定等于7
D.0.5 mol/L的醋酸钠溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
难度: 困难查看答案及解析
-
某稀溶液中含有等物质的量的(均为1mol)ZnSO4、Fe2(SO4)3、H2SO4、CuSO4,向其中逐渐加入铁粉。下列各图表示溶液中的Fe2+的物质的量与加入铁粉的物质的量之间的关系,其中正确的是( )
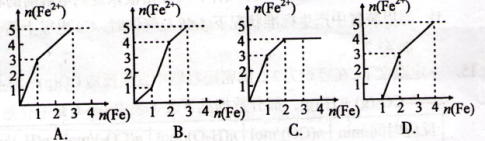
难度: 中等查看答案及解析
-
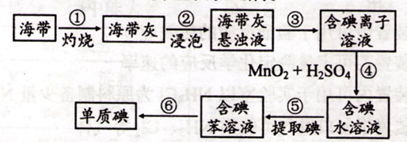
钢铁等铁制品是应用最广泛的金属材料,铁元素的单质及其化合物在元素化合物世界始终扮演着重要角色。
I.打磨过的细铁丝可在纯氧中剧烈燃烧,最终生成黑色固体,其化学式为________;铁粉与水蒸气在高温下也可生成该黑色固体,反应的化学方程式为________。
II.某校探究性学习小组用已部分生锈的废铁屑制作印刷电路板的腐蚀剂,并回收铜。探究过程如下:
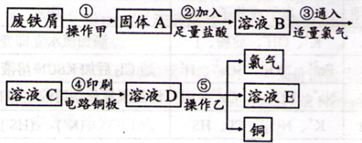
请回答下列问题:
(1)步骤②中,除发生反应Fe +2HCl=FeCl2+H2↑外,其他可能反应的离子方程式为________。
(2)若溶液B中只含有Fe2+而不含Fe3+,可证明该事实的实验方法是( )
①先加氯水,后加KSCN溶液后显红色;
②先加KSCN溶液,不显红色,再加氯水后显红色;
③滴加NaOH溶液,只产生白色沉淀,迅速变为灰绿色,最后呈红褐色;
④只滴加KSCN溶液不显红色。
A.①② B.②⑨ C.⑨④ D.①④
(3)步骤⑤产生金属铜的化学方程式为________。
Ⅲ.金属的腐蚀所导致的钢铁损耗占钢铁年产量的l/4还多。在钢铁的吸氧腐蚀过程中,正极反应式为________,若此过程中共生成了8 gFe2O3,则转移的电子的物质的量为________。
难度: 困难查看答案及解析
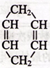 可简写为
可简写为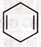 。现有某化合物x的分子结构可表示为
。现有某化合物x的分子结构可表示为