-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.1.0 mol·L-1的KNO3溶液:H+、Fe2+、Cl-、SO42-
B.甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl-
C.pH=12的溶液:K+、Na+、CH3COO-、Br-
D.与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3-
难度: 困难查看答案及解析
-
化学与人类生活、社会可持续发展密切相关,下列措施有利于节能减排、保护环境的是
①加快化石燃料的开采与使用;②研发易降解的生物农药;
③应用高效洁净的能源转换技术;④田间焚烧秸秆;
⑤推广使用节能环保材料。
A.①③⑤ B.②③⑤ C.①②④ D.②④⑤
难度: 简单查看答案及解析
-
设nA为阿伏伽德罗常数的数值,下列说法正确的是
A.1molFe2+ 与足量的H2O2溶液反应,转移2nA个电子
B.1L0.1mol•L-1的氨水含有0.1nA个OH―
C.常温常压下,22.4LCCl4含有个nA个CCl4分子
D.常温下,23g NO2含有nA个氧原子
难度: 简单查看答案及解析
-
120 mL含有0.20 mol碳酸钠的溶液和200 mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是
A.2.0mol/L B.1.5 mol/L C.0.18 mol/L D.0.24mol/L
难度: 简单查看答案及解析
-
氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既非氧化剂又非还原剂等。下列反应与Br2+SO2+2H2O=H2SO4+2HBr相比较,水的作用不相同的是
A.2Na2O2+2H2O=4NaOH+O2↑ B.4Fe(OH)2+O2+2H2O=4Fe(OH)3
C.Cl2+H2O=HCl+HClO D.2Al+2NaOH+2H2O=2NaAlO2+3H2↑
难度: 简单查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是
A.FeCl3溶液与Cu的反应:Cu+Fe3+=Cu2++Fe2+
B.NO2与水的反应:3NO2+H2O=2NO3-+NO+2H+
C.醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+=Ca2++H2O+CO2↑
D.向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
难度: 简单查看答案及解析
-
Al、Fe、Cu都是重要的金属元素。下列说法正确的是
A.三者对应的氧化物均为碱性氧化物
B.三者的单质放置在空气中均只生成氧化物
C.制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法
D.电解AlCl3、FeCl3、CuCl2的混合溶液是阴极上依次析出Cu、Fe、Al
难度: 简单查看答案及解析
-
下列叙述正确的是
A.Fe分别与氯气和稀盐酸反应所得氯化物相同
B.K、Zn分别与不足量的稀盐酸反应所得溶液均呈中性
C.Li、Na、K的原子半径和密度随原子序数的增加而增加
D.C、P、S、Cl的高价氧化物对应水化物的酸性逐渐增强
难度: 简单查看答案及解析
-
对滴有酚酞试液的下列溶液,操作后颜色变深的是
A.明矾溶液加热 B.CH3COONa溶液加热
C.氨水中加入少量NH4Cl D.小苏打溶液中加入少量的NaCl固体
难度: 简单查看答案及解析
-
用98%的浓H2SO4(ρ=1.84 g·cm-3)配制1 mol·L-1的稀硫酸100 mL,按配制溶液时仪器的选用顺序排列,选择正确的是
①玻璃棒 ②胶头滴管 ③100 mL容量瓶 ④托盘天平 ⑤50 mL烧杯 ⑥10 mL量筒 ⑦100 mL量筒 ⑧移液管 ⑨滴定管
A.⑥③⑧⑤①② B.③①⑨② C.④⑤③②①⑨ D.⑥⑤①③②
难度: 简单查看答案及解析
-
以下实验装置一般不用于分离物质的是
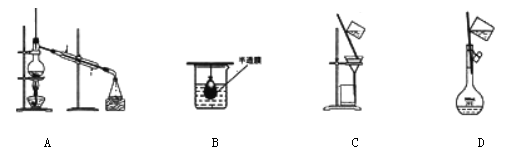
难度: 简单查看答案及解析
-
右图表示在某溶液中滴加Ba(OH)2溶液时,沉淀的物质的量随Ba(OH)2的物质的量的变化关系。该溶液的成分可能是

A.MgSO4 B.KAl(SO4)2 C.Al2(SO4)3 D.NaAlO2
难度: 简单查看答案及解析
-
已知硫酸亚铁溶液中加入过氧化钠时发生反应:4Fe2++4Na2O2+6H2O===4Fe(OH)3↓+O2↑+8Na+,则下列说法正确的是
A.该反应中Fe2+是还原剂,O2是还原产物
B.4 mol Na2O2在反应中共得到8NA个电子
C.Fe(OH)3是氧化产物也是还原产物,每生成4 mol Fe(OH)3反应过程中共转移电子6 mol
D.反应过程中可以看到白色沉淀转化为灰绿色再转化为红褐色沉淀
难度: 简单查看答案及解析
-
一定量的质量分数为14%的KOH溶液,若将其蒸发掉100 g水后,其质量分数为28%,体积为80 mL,则浓缩后的KOH的物质的量浓度为
A.2.2 mol·L-1 B.4 mol·L-1 C.5 mol·L-1 D.6.25 mol·L-1
难度: 简单查看答案及解析
-
将Mg、Cu组成的混合物26.4 g,投入到适量的稀硝酸中,固体完全溶解,收集到标准状况下的NO气体8.96 L,向反应后的溶液中加入过量的5mol/L的NaOH溶液300 mL,金属离子完全沉淀。则形成沉淀的质量是
A.32.8g B.46.8g C.53.6g D.63.8g
难度: 简单查看答案及解析
-
下列化学实验事实及其解释都正确的是
A.铝箔在酒精灯火焰上加热熔化但不滴落,说明铝箔表面氧化铝膜熔点高于铝
B.将SO2通入含HClO的溶液中,生成H2SO4,说明HClO酸性比H2SO4强
C.FeCl3溶液可以腐蚀线路板上的Cu,说明Fe的金属活动性大于Cu
D.将饱和氯水滴到淀粉碘化钾试纸上,试纸先变蓝后变白,说明氯水具有漂白性
难度: 简单查看答案及解析