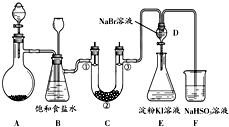
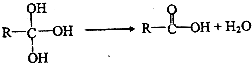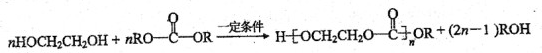-
化学与生产、生活、社会密切相关,下列说法正确的是( )
A.钢筋混凝土、玻璃钢、石棉瓦、碳纤维增强陶瓷都是常见的复合材料
B.蛋白质、棉花、核酸、PVC、淀粉、油脂都是由高分子组成的物质
C.淀粉和纤维素,都可用(C6Hl0O5)n表示,但淀粉能发生银镜反应,而纤维素不能
D.“PM2.5”是指大气中直径小于或等于2.5微米(1微米=1×10-6米)的颗粒,“PM2.5”与空气形成的分散系属于胶体难度: 中等查看答案及解析
-
下列表述正确的是( )
A.BF3的电子式为
B.2CH3CH2OD+O22CH3CHO+2DHO
C.二氧化硫、氨、煤的液化均为物理变化
D.在鸡蛋白溶液中加入浓Na2SO4溶液,蛋白质的性质会改变并发生变性难度: 中等查看答案及解析
-
实验现象是物质性质的反映,下列对实验现象的解释或由此得出的结论不正确的是( )
选项 实验 现象 解释或结论 A 将SO2通入Ba(NO3)2溶液中 溶液变浑浊并有
少量气泡冒出生成BaSO4沉淀
和NO气体B 铝箔1(末打磨)和铝箔2(已打磨)分别在空气中灼烧 铝箔均熔化但不
滴落熔点:Al2O3>Al C 淀粉水解后,立即加入新制的氢氧化铜悬浊液加热,充分反应 无砖红色沉淀生
成该淀粉未水解 D 1mol某醇与足量的钠反应 生成22.4L氢气 (标况下) 该醇为二元醇
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
已知电离平衡常数:H2CO3>HClO>HCO3-,氧化性:HClO>O2>Br2>Fe3+>I2.下列有关离子反应或离子方程式的叙述中,正确的是( )
A.能使pH试纸显深红色的溶液中,Fe3+、Cl-、Ba2+、Br-能大量共存
B.Na2S溶液呈碱性的原因S2-+2H2O⇌H2S+2OH-
C.NaClO溶液中通入少量二氧化碳的离子方程式2ClO-+CO2+H2O=2HClO+CO32-
D.向FeI2溶液中滴加少量氯水,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-难度: 中等查看答案及解析
-
下列说法正确的是( )
A.稀释Na2CO3溶液时,c(HCO3-)、均增大
B.常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s)的△H<0,△S<0
C.用0.1mol•L-1CH3COOH溶液滴定0.1mol•L-1 NaOH至中性时:c(CH3COO-)+c(CH3COOH)=c(Na+)
D.向纯水中加入盐酸或氢氧化钠都能使水的电离平衡逆向移动,水的离子积减小难度: 中等查看答案及解析
-
关于下列各图的叙述,正确的是( )
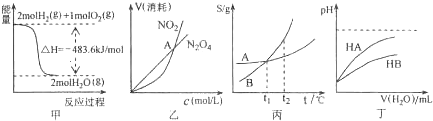
A.甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483.6Kj•mol-1
B.乙表示恒温恒容条件下发生的可逆反应2NO2⇔N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙表示A、B两物质的溶解度随温度变化情况,将A、B饱和溶液分别由t1℃升温至t2℃时,溶质的质量分数B>A
D.丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH小于NaB溶液难度: 中等查看答案及解析
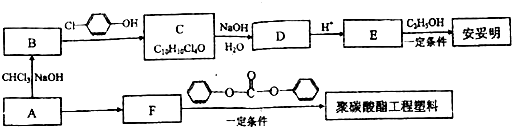
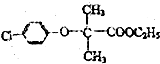 )和碳酸酯工程塑料(
)和碳酸酯工程塑料(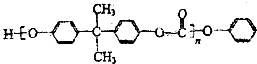 )的原料之一.
)的原料之一.