-
二甲醚(CH3OCH3)被称为21世纪的清洁、高效能源.
Ⅰ.(1)合成二甲醚反应一:
3H2(g)+2CO(g)⇌CH3OCH3(g)+CO2(g)△H=-247KJ/mol
一定条件下该反应在密闭容器中达到平衡后,要提高CO的转化率,可以采取的措施是______.
A、低温高压 B、加催化剂 C、体积不变充入N2
D、增加CO浓度 E、分离出二甲醚
(2)合成二甲醚反应二:2CH3OH(g)⇌CH3OCH3(g)+H2O(g).在不同温度下,分别在1L密闭容器中加入不同物质的量的CH3OH,反应达到平衡,测得各组分的浓度如表:‘
| 实验组 | 温度/K | 平衡浓度mol/L |
| CH3OH | CH3OCH3 | H2O |
| 1 | 403 | 0.01 | 0.2 | 0.2 |
| 2 | 453 | 0.02 | 0.3 | 0.4 |
该反应是______(填“放热”或“吸热”)反应,原因是______(从平衡常数角度说明).
Ⅱ.二甲醚燃料电池的工作原理如下图一所示.
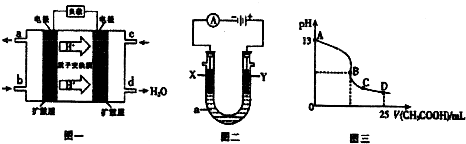
(1)该电池正极的电极反应式为______.
电池在放电过程中,b对应的电极溶液的pH______.(填“增大”、“减小”或“不变”)
(2)以上述电池为电源,通过导线与图二电解池相连.X、Y为石墨,a为1L0.1mol/LKCl溶液,写出电解总反应的离子方程式为______ Cl2↑+H2↑+2OH-
-
甲醇(CH3OH)和二甲醚(CH3OCH3)被称为21世纪的新型燃料,具有清洁、高效等性能。
(1)CO2可用于合成二甲醚(CH3OCH3),有关反应的热化学方程式如下:
CO2(g) + 3H2(g)=CH3OH(g) + H2O(g) △H=-49.0 kJ·mol-1
2CH3OH(g)=CH3OCH3(g) + H2O(g) △H=-23.5 kJ·mol-1
H2O(l)=H2O(g) △H= + 44 kJ·mol-1
则CO2与H2反应合成二甲醚生成液态水的热化学方程式为:____________________。
(2)工业上合成甲醇的反应:CO(g)+2H2(g) CH3OH(g) △H=-90.8 kJ·mol-1。 下列不能说明该反应在恒温恒容条件下已达化学平衡状态的是___________
CH3OH(g) △H=-90.8 kJ·mol-1。 下列不能说明该反应在恒温恒容条件下已达化学平衡状态的是___________
A.v正(H2) = 2v逆(CH3OH) B.n(CO):n(H2):n(CH3OH)=1:2:1
C.混合气体的密度不变 D.混合气体的平均相对分子质量不变 E.容器的压强不变
(3)若反应2CH3OH(g)  CH3OCH3(g) + H2O(g)在某温度下的化学平衡常数为400,此温度下,在密闭容器中加入一定量甲醇,反应进行到某时刻,测得各物质的浓度如下表所示:
CH3OCH3(g) + H2O(g)在某温度下的化学平衡常数为400,此温度下,在密闭容器中加入一定量甲醇,反应进行到某时刻,测得各物质的浓度如下表所示:
| 物质 | CH3OH(g) | CH3OCH3(g) | H2O(g) |
| 浓度(mol·L-1) | 0.44 | 0.60 | 0.60 |
①比较该时刻正、逆反应速率的大小:v(正)_____v(逆)(填“>”、“<”或“=”)。
②若加入甲醇后,经10 min反应达到平衡,则平衡后c(CH3OH)=______________,
该时间内反应速率v(CH3OCH3)=_____________。
(4)利用二甲醚(CH3OCH3)设计一个燃料电池,用KOH溶液作电解质溶液,石墨做电极,该电池负极电极反应式为___________________________。以此燃料电池作为外接电源按如图所示电解硫酸铜溶液,如果起始时盛有1000mLpH=5的硫酸铜溶液(25℃,CuSO4足量),一段时间后溶液的pH变为1,若要使溶液恢复到起始浓度(温度不变,忽略溶液体积的变化),可向溶液中加入______其质量约为_____g。

-
二甲醚(CH3OCH3)是一种新型能源,被誉为“21世纪的清洁燃料”。
(1)用CO和H2合成二甲醚的反应为:3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)△H。
CH3OCH3(g)+CO2(g)△H。
几种物质的相对能量如下:
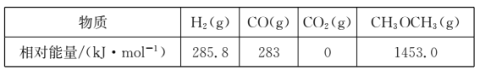
△H=______kJ·mo1。改变下列“量”,一定会引起△H发生变化的是_____(填代号)。
A.温度 B.反应物浓度 C.催化剂 D.化学计量数
(2)有利于提高反应中CH3OCH3产率的条件为_______(填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
(3)采用新型催化剂(主要成分是Cu—Mn的合金)制备二甲醚。催化剂中n(Mn)/n(Cu)对合成二甲醚的影响情况如下图所示。
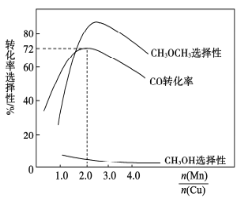
当n(Mn)/n(Cu)=2时,二甲醚的选择性(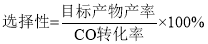 )为85.8%,此时二甲醚的产率为_________。
)为85.8%,此时二甲醚的产率为_________。
(4)用二甲醚燃料电池电解法可将酸性含铬废水(主要含有Cr2O72-)转化为Cr3+。原理如下图:
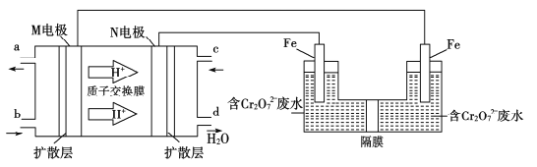
①燃料电池中的负极是______(填“M”或“N”)电极。电解池阴极的电极反应式为______________________________。
②消耗6.9g二甲醚时可处理Cr的含量为26.0g·L-1的废水1L,该套装置的能量利用率为___________。(保留3位有效数字)
-
二甲醚(CH3OCH3)被称为21世纪的新型能源,是一种高效、清洁能源.
Ⅰ.工业制备二甲醚的生产流程如下: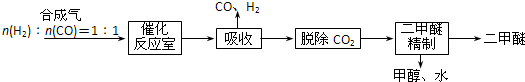
催化反应室中(压力2.0~10.0Mpa,温度230~280℃)发生如下反应:
①CO(g)+2H2(g)⇌CH3OH(g)△H=-90.7kJ/mol
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H=-23.5kJ/mol
③CO(g)+H2O(g)⇌CO2(g)+H2(g)△H=-41.2kJ/mol
(1)二甲醚也可以通过天然气和CO2合成制得,该反应的化学方程式为______.
(2)催化反应室中总反应3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g)的△H=______,830℃时反应③的K=1.0,则在催化反应室中反应③的K______1.0(填“>”、“<”或“=”).
(3)在温度相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒压,发生反应②,测得反应达到平衡时的有关数据如下.
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol CH3OCH3、1mol H2O | 2mol CH3OH | 1mol CH3OH |
| CH3OH的浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | 吸收a kJ | 放出b kJ | 放出c kJ |
| 平衡时体积(L) | V1 | V2 | V3 |
| 反应物转化率 | α 1 | α 2 | α 3 |
下列说法正确的是______.(填字母序号)
A.a+2c=23.5 B.α1+α2=1 C.V1>V3 D.c1=2c3
(4)上述生产流程中,可以循环使用的物质有______.
Ⅱ.用二甲醚-空气碱性(KOH)燃料电池作电源电解精炼粗铜(如图),在接通电路一段时间纯Cu质量增加3.2g.
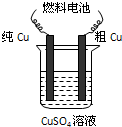
(5)请写出燃料电池中的负极反应式:______.
(6)燃料电池正极消耗标准状况下空气的体积是______(空气中O2体积分数以20%计算).
-
二甲醚(CH3OCH3)被称为21世纪的新型能源,它清洁、高效、具有优良的环保性能。
Ⅰ.工业制备二甲醚的生产流程如下:
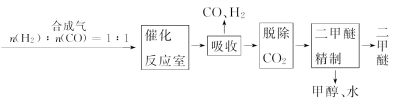
催化反应室中(压强2.0~10.0 MPa,温度230~280℃)进行下列反应:
CO(g)+2H2(g)  CH3OH(g)ΔH=-90.7 kJ/mol ①
CH3OH(g)ΔH=-90.7 kJ/mol ①
2CH3OH(g)  CH3OCH3(g)+H2O(g)ΔH=-23.5 kJ/mol ②
CH3OCH3(g)+H2O(g)ΔH=-23.5 kJ/mol ②
CO(g)+H2O(g)  CO2(g)+H2(g)ΔH=-41.2 kJ/mol ③
CO2(g)+H2(g)ΔH=-41.2 kJ/mol ③
(1)甲烷氧化可制得合成气,反应如下:CH4(g)+ O2(g)
O2(g)  CO(g)+2H2(g) ΔH=-35.6 kJ/mol。该反应是 反应(填“自发”或“非自发”)。
CO(g)+2H2(g) ΔH=-35.6 kJ/mol。该反应是 反应(填“自发”或“非自发”)。
(2)催化反应室中总反应3CO(g)+3H2(g)  CH3OCH3(g)+CO2(g)的ΔH= 。830℃时反应③的K=1.0,则在催化反应室中反应③的K 1.0(填“>”、“<”或“=”)。
CH3OCH3(g)+CO2(g)的ΔH= 。830℃时反应③的K=1.0,则在催化反应室中反应③的K 1.0(填“>”、“<”或“=”)。
(3)上述反应中,可以循环使用的物质有 。
Ⅱ.如图为绿色电源“二甲醚燃料电池”的工作原理示意图。b电极是 极。
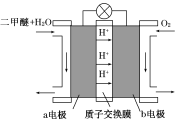
-
二甲醚(CH3OCH3)被称为21世纪的新型能源,它清洁、高效、具有优良的环保性能.
Ⅰ.工业制备二甲醚的生产流程如下:
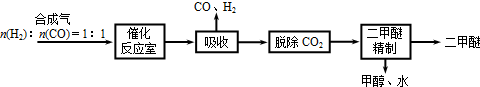
催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
①CO(g)+2H2(g)⇌CH3OH(g)△H=-90.7kJ/mol
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H=-23.5kJ/mol
③CO(g)+H2O(g)⇌CO2(g)+H2(g)△H=-41.2kJ/mol
(1)甲烷氧化可制合成气:CH4(g)+ O2(g)⇌CO(g)+2H2(g)△H=-35.6kJ/mol,该反应是______反应(填“自发”或“非自发”).
O2(g)⇌CO(g)+2H2(g)△H=-35.6kJ/mol,该反应是______反应(填“自发”或“非自发”).
(2)催化反应室中总反应3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g)的△H=______.830℃时反应③的K=1.0,则在催化反应室中反应③的K______1.0(填“>”、“<”或“=”)
(3)上述流程中,可循环使用的物质有______.
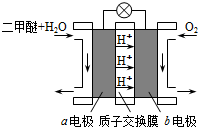
Ⅱ.如图为绿色电源“直接二甲醚燃料电池”的工作原理示意图.
(1)b电极是______极.
(2)a电极的反应式为______.
-
二甲醚(CH3OCH3)是一种清洁、高效、具有优良的环保性能的可燃物,被称为21世纪的新型能源.工业制备二甲醚的生产流程如图1:
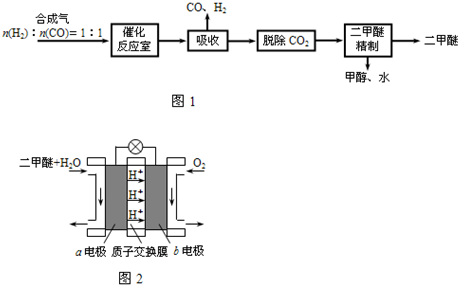
催化反应室中(压力2.0~10.0Mpa,温度300℃)进行下列反应:
①CO(g)+2H2(g)⇌CH3OH(g)△H=-90.7kJ/mol
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H=-23.5kJ/mol
③CO(g)+H2O(g)⇌CO2(g)+H2(g)△H=-41.2kJ/mol
(1)催化反应室中的总反应:3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g).
该反应的△H=________.催化反应室中采用300℃的反应温度,理由是________.
(2)已知:反应①在300℃时的化学平衡常数为0.27.该温度下将2mol CO、3mol H2和2mol CH3OH充入容积为2L的密闭容器中,此时反应将________(填“正向进行”、“逆向进行”或“处于平衡状态”).
(3)上述流程中二甲醚精制的实验操作名称为________.
(4)图2为绿色电源“二甲醚燃料电池”的工作原理示意图.a电极的电极反应式为________.
-
(14分)二甲醚(CH3OCH3)是一种清洁、高效、具有优良的环保性能的可燃物,被称为21世纪的新型能源。工业制备二甲醚的生产流程如下:
催化反应室中(压力2.0~10.0MPa,温度300℃)进行下列反应:
①CO(g)+2H2(g) CH3OH(g) △H 1= - 90.7 kJ·mol-1
CH3OH(g) △H 1= - 90.7 kJ·mol-1
②2CH3OH(g)  CH3OCH3(g)+H2O(g) △H2 = - 23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H2 = - 23.5 kJ·mol-1
③CO(g)+H2O(g)  CO2(g)+H2(g) △H3 = - 41.2 kJ·mol-1
CO2(g)+H2(g) △H3 = - 41.2 kJ·mol-1
(1)催化反应室中的总反应:3CO(g)+3H2(g)  CH3OCH3(g)+CO2(g)。
CH3OCH3(g)+CO2(g)。
该反应的反应热△H =_________。催化反应室中采用300℃的反应温度,理由是 。
(2)已知:反应①在300℃时的化学平衡常数为0.27。该温度下将2 mol CO、3 mol H2和2 mol CH3OH充入容积为2 L的密闭容器中,此时反应将 (填“正向进行”、“逆向进行”或“处于平衡状态”)。
(3)上述流程中二甲醚精制的实验操作名称为 。
(4)右图为绿色电源“二甲醚燃料电池”的工作原理示意图。
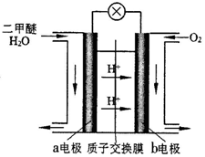
该电池工作时,H+向 极移动(填“正”或“负”);a电极的电极反应式为 。
-
二甲醚(CH3OCH3)具有优良的燃烧性能,被称为21世纪的“清洁能源”.一步法合成二甲醚是以合成气(CO/H2)为原料,在一定温度、压强和催化剂作用下进行,反应器中发生了下列反应:
①CO(g)+2H2(g )⇌CH3OH(g);△H1=90.7 kJ•mol-1
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g);△H2=23.5 kJ•mol-1
③CO(g)+H2O⇌(g)CO2(g)+H2(g);△H3=41.2 kJ•mol-1
(1)-步法合成二甲醚的总反应可表示为3CO(g)+3H2(g)CH3OCH3(g)+CO2(g),该反应的AH=________.平衡常数表达式为________.
(2)另一种合成二甲醚的方法称为“二步法”,该工艺为让反应①和反应②分别在不同的反应器中进行,无反应③发生,而“一步法”的反应③的发生提高了CH3OCH3的产率,原因是________.
(3)由CO2加氢直接合成二甲醚可以消除过度CO2排放对环境的影响.当在合成反应器中加入碳氢比[n(CO2)/n(H2)]为1:3的混合气体,在一定条件下反应得到二甲醚和水蒸气,实现了CO2的减排目的.该反应的反应方程式为________; 判断该反应在一定温度下,体积恒定的密闭容器中下列不能作为达到化学平衡状态的依据是________
A.容器的密度不变
B.容器内压强保持不变
C,平均摩尔质量保持不变
D.单位时间内消耗2mol CO2,同时消耗1mol二甲醚
(4)以二甲醚为燃料的燃料电池工作原理如图所示:则正极为________(填A极或B极),写出A电极反应式________.

-
甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455 kJ/mol,甲醚可作燃料电池的燃料。工业上用合成气(CO、H2)直接或间接制取甲醚。
(1)写出甲醚燃烧的热化学方程式________。
(2)已知H2(g)和C(s)的燃烧热分别是285.8 kJ·mol-1、393.5 kJ·mol-1;计算反应4C(s)+6H2(g)+O2(g)==2CH2OCH3(g)的反应热为________。(3)以甲醚、空气、氢氧化钾溶液为原料,石墨为电极
可构成燃料电池。该电池的负极反应式为________
________;
从能量角度分析甲醚用作燃料电池与直接燃烧相比
主要的优点是________。
(4)用(3)中的燃料电池为电源,以石墨为电极电解
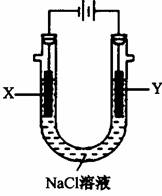
500 mL滴有酚酞的:NaCl溶液,装置如图所示:
①请写出电解过程中Y电极附近观察到的现象
________。
②当燃料电池消耗2.8 LO2(标准状况下)时,计算
此时:NaCl溶液的pH=________(假设溶液的体积不变,气体全部从溶液中逸出)。




 )为85.8%,此时二甲醚的产率为_________。
)为85.8%,此时二甲醚的产率为_________。