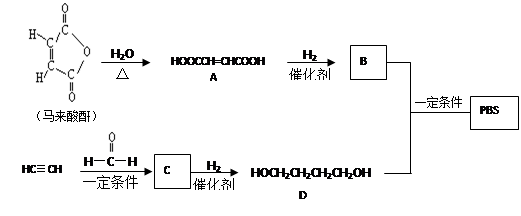
-
科学家最近研究出一种环保、安全的储氢方法,其原理可表示为:
NaHCO3+H2HCOONa+H2O下列有关说法正确的是
A.储氢、释氢过程均无能量变化
B.NaHCO3、HCOONa均含有离子键和共价键
C.储氢过程中,NaHCO3被氧化
D.释氢过程中,每消耗0.1molH2O放出2.24L的H2
难度: 中等查看答案及解析
-
下列离子或分子在溶液中能大量共存,通入CO2后仍能大量共存的一组是
A.K+、Na+、Cl—、NO3— B.K+、Na+、Br—、SiO32—
C.H+、Fe2+、SO42—、Cl2 D.K+、Ag+、NH3·H2O、NO3—
难度: 中等查看答案及解析
-
一定条件下,通过下列反应可实现燃煤烟气中硫的回收:
SO2(g)+2CO(g)
2CO2(g)+S(l) △H<0 若反应在恒容的密闭容器中进行,下列有关说法正确的是
A.平衡前,随着反应的进行,容器内压强始终不变
B.平衡时,其他条件不变,分离出硫,正反应速率加快
C.平衡时,其他条件不变,升高温度可提高SO2的转化率
D.其他条件不变,使用不同催化剂,该反应平衡常数不变
难度: 中等查看答案及解析
-
仅用下表提供的玻璃容器(非玻璃容器任选)就能实现相应实验目的的是
选项
实验目的
玻璃容器
A
分离乙醇和乙酸乙酯的混合物
分液漏斗、烧杯
B
用pH=1的盐酸配置100mL,pH=2的盐酸
100mL容量瓶、烧杯、玻璃棒、胶头滴管
C
用溴水、淀粉—KI溶液比较Br2与I2的氧化性强弱
试管、胶头滴管
D
用NH4Cl固体和Ca(OH)2固体制备并收集NH3
酒精灯、烧杯、导管、集气瓶
难度: 中等查看答案及解析
-
某兴趣小组设计如下微型实验装置。实验时,现断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表指针偏转,下列有关描述正确的是
A.断开K2,闭合K1时,总反应的离子方程式为:2H++2Cl—
Cl2↑+H2↑
B.断开K2,闭合K1时,石墨电极附近溶液变红
C.断开K1,闭合K2时,铜电极上的电极反应为:Cl2+2e—=2Cl—
D.断开K1,闭合K2时,石墨电极作正极
难度: 中等查看答案及解析
-
氢氟酸是一种弱酸,可用来刻蚀玻璃。已知25℃时
①HF(aq)+OH—(aq)=F—(aq)+H2O(l) △H=—67.7KJ·mol—1
②H+(aq)+OH—(aq)=H2O(l) △H=—57.3KJ·mol—1
在20mL0.1·molL—1氢氟酸中加入VmL0.1mol·L—1NaOH溶液,下列有关说法正确的是
A.氢氟酸的电离方程式及热效应可表示为HF(aq)=H+(aq) +F−(aq) △H=+10.4KJ·mol—1
B.当V=20时,溶液中:c(OH—)=c(HF) +c(H+)
C.当V=20时,溶液中:c(F—)<c(Na+)=0.1mol·L—1
D.当V>0时,溶液中一定存在:c(Na+)>c(F—)>c(OH—)>c(H+)
难度: 中等查看答案及解析
-
已知室温下,Al(OH)3的Ksp或溶解度远大于Fe(OH)3。向浓度均为0.1mol·L—1的Fe(NO3)3和Al(NO3)3混合溶液中,逐滴加入NaOH溶液。下列示意图表示生成Al(OH)3的物质的量与加入NaOH溶液的体积的关系,合理的是
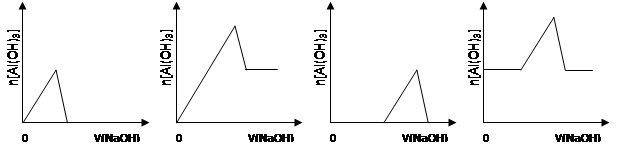
难度: 中等查看答案及解析
-
(15分)亚硫酸盐是一种常见食品添加剂。为检验某食品中亚硫酸盐含量(通常1kg样品中含SO2的质量计),某研究小组设计了如下两种实验流程:
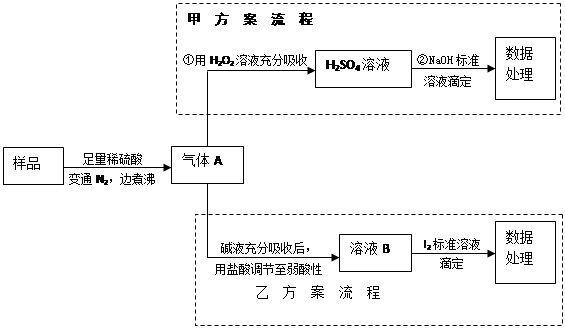
(1)气体A的主要成分是________,为防止煮沸时发生暴沸,必须先向烧瓶中加入________
________;通入N2的目的是。
(2)写出甲方案第①步反应的离子方程式:________。
(3)甲方案第②步滴定前,滴定管需用NaOH标准溶液润洗,其操作方法是________
________。
(4)若用盐酸代替稀硫酸处理样品,则按乙方案实验测定的结果________(填“偏高”、“偏低”或“无影响”)
(5)若取样品wg,按乙方案测得消耗0.01000mol·L—1I2溶液VmL,则1kg样品中含SO2的质量是________g(用含w、V的代数式表示)。
难度: 中等查看答案及解析