-
下列物质中属于强电解质的是
A.NH3·H2O B.Cu C.饱和食盐水 D.醋酸铵
难度: 简单查看答案及解析
-
下列说法正确的是
A.已知FeO(s)+C(s)= CO(g )+ Fe(s)的DH>0,该反应在任何温度下都为自发过程
B.能源是提供能量的资源,它包括化石燃料(煤、石油、天然气),不包括阳光、海水
C.对于同一个化学反应,无论是一步完成还是分几步完成,其反应的焓变相同
D.在一个确定的化学反应关系中,反应物的总能量总高于生成物的总能量
难度: 简单查看答案及解析
-
下列事实不能用勒夏特列原理解释的是
A.棕红色NO2加压后颜色先变深后变浅
B.钢铁在潮湿的空气中容易生锈
C.实验室可用排饱和食盐水的方法收集氯气
D.常温下,将1mLpH=3的醋酸溶液加水稀释至l00mL,测得其pH<5
难度: 简单查看答案及解析
-
在密闭容器中A与B反应生成C,其反应速率分别用v(A)、v(B)、v(C)表示,已知v(A)、v(B)、v(C)之间有以下关系3v(A)==2v(B)、3v(C)==2v(B),则此反应可表示为
A.2A +3B==2C B.A+3B==2C C.3A+B==2C D.A +B==C
难度: 简单查看答案及解析
-
在一密闭容器中充入1mol H2和1mol I2(g),并在一定温度下使其发生反应:H2(g)+I2(g)
2HI(g) DH<0。下列说法正确的是
A.保持容器容积不变,向其中加入1molH2,反应速率不变
B.保持容器容积不变,向其中加入1molAr,压强增大,平衡正向移动
C.保持容器内气体压强不变,向其中加入1molAr,化学平衡常数增大
D.保持容器内气体压强不变,向其中加入1mol H2(g)和1mol I2(g),化学平衡不移动
难度: 简单查看答案及解析
-
下列说法中正确的是
A.在Na3PO4溶液中,c(Na+) 是c(PO43-)的3倍
B.pH=3的盐酸中,其c(H+)是pH=1的盐酸的3倍
C.0.1mol/L KOH溶液和0.1mol/L氨水中,其c(OH-)相等
D.在25°C时,无论是酸性、碱性还是中性溶液中,其c(H+)和c(OH-)的乘积都等于1
难度: 简单查看答案及解析
-
25℃时,水的电离达到平衡:H2O
H++OH-;DH>0,下列叙述正确的是
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.将水加热,KW增大,pH不变
C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D.向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变
难度: 简单查看答案及解析
-
关于中和热测定实验的下列说法不正确的是
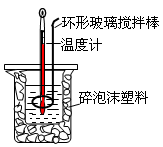
A. 烧杯间填满碎泡沫塑料是减少实验过程中的热量损失
B. 使用环形玻璃棒既可以搅拌又避免损坏温度计
C.向盛装酸的烧杯中加碱时要小心缓慢
D.测定酸后的温度计要用蒸馏水清洗干燥后再测碱的温度
难度: 简单查看答案及解析
-
常温下,下列各组离子一定能大量共存的是
A.滴加甲基橙试剂显红色的溶液中:Na+、Fe2+、Cl-、NO3-
B.c(H+)=10-12 mol·L-1的溶液:K+、Ba2+、Cl-、Br-
C.c(OH-)/ c(H+)=1012的溶液中:NH4+、Al3+、NO3-、CO32-
D.由水电离的c(H+)=1.0×10-13 mol·L-1的溶液中:K+、NH4+、AlO2-、HCO3-
难度: 简单查看答案及解析
-
下列关于热化学反应的描述中正确的是
A.已知H+(aq) + OH-(aq) = H2O(l) DH=-57.3kJ·mol-1,则H2SO4和Ba(OH)2反应的反应热DH=-114.6kJ·mol-1
B.密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量, 则Fe(s)+S(s)=FeS(s) DH= +95.6 kJ·mol-1
C.常温时H2(g)的燃烧热是285.8 kJ·mol-1,则2H2O(g)=2H2(g)+O2(g) DH=+571.6 kJ·mol-1
D.常温时葡萄糖的燃烧热是2800 kJ·mol-1,则1/2C6H12O6(s)+3O2(g)=3CO2(g)+3H2O( l )
DH=-1400 kJ·mol-1
难度: 简单查看答案及解析
-
在恒容的密闭容器中,下列反应分别达到平衡后,有关说法正确的是
A.2HI(g)
H2(g)+I2(g);DH>0,若降低温度,颜色加深,压强增大
B.2NO2(g)
N2O4(g);DH<0,充入氩气,压强增大,红棕色变浅
C.2SO2(g)+O2(g)
2SO3(g);DH<0,升温后,平均相对分子质量减小
D.3Fe(s)+4H2O(g)
Fe3O4(s)+4H2(g);DH<0,加入铁后,Fe3O4将增加
难度: 简单查看答案及解析
-
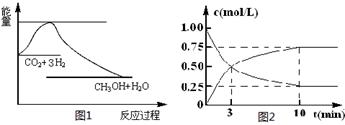
下图为某化学反应速率—时间图,在t1时刻升高温度或增大压强,都符合下图所示变化的反应是
A.2SO2 (g)+O2 (g)
2SO3 (g) DH<0
B.4NH3 (g)+5O2 (g)
4NO(g)+6H2O (g) DH<0
C.H2 (g)+I2 (g)
2HI (g) DH>0
D.C (s)+H2O (g)
CO (g)+H2 (g) DH>0
难度: 简单查看答案及解析
-
下面有关电化学的图示,完全正确的是
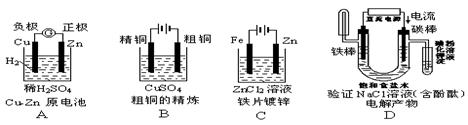
难度: 简单查看答案及解析
-
对于0.1mol·L-1 Na2SO3溶液,正确的是
A.升高温度,溶液的pH降低
B.c(Na+)=2c(SO32-)+ c(HSO3-)+ c(H2SO3)
C.c(Na+)+c(H+)=2 c(SO32-)+ 2c(HSO3-)+ c(OH-)
D.加入少量NaOH固体,c(SO32-)与c(Na+)均增大
难度: 简单查看答案及解析
-
一定条件下,在密闭容器里进行如下可逆反应:S2Cl2(橙黄色液体)+Cl2(气)
2SCl2(鲜红色液体) DH=-61.16kJ·mol-1。下列说法正确的是
A.单位时间里生成n mol S2Cl2的同时也生成n mol SCl2
B.达到平衡时,若升高温度,压强不变,氯气转化率增大
C.达到平衡时,单位时间里消耗 n mol S2Cl2的同时也生成n molCl2
D.加入氯气,平衡向正反应方向移动,氯气的转化率一定升高
难度: 简单查看答案及解析
-
25℃时,在等体积的 ① pH=0的H2SO4溶液 ②0.05mol/L的Ba(OH)2溶液 ③pH=10的Na2S溶液 ④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是
A.1:10:10
:10
B. 1:5:5×10
:5×10
C.1:20:10
:10
D.1:10:10
:10
难度: 简单查看答案及解析
-
把6molA和5molB两气体通入容积为4L的密闭容器中,一定条件下反应:
3A(g)+ B(g)
2C(g)+xD(g) DH<0 ;5min达平衡,此时生成2molC,测得D的平均反应速率为0.1mol·(L·min)-1.下列说法中正确的是
A.A的平均反应速率为0.15mol·(L·min)-1
B.恒温下达到平衡的标志是C和D的生成速率相等
C.降低温度,逆反应速率变小,正反应速率增大,平衡正向移动
D. B的转化率为25%
难度: 简单查看答案及解析
-
能促进水的电离,并使溶液中c(H+)>c(OH-)的操作是
①将水加热煮沸 ②向水中投入一小块金属钠 ③向水中通CO2
④向水中通NH3 ⑤向水中加入明矾晶体 ⑥向水中加入NaHCO3固体
⑦向水中加NaHSO4固体
A.①③⑥⑦ B.①③⑤⑥ C.⑤⑦ D.⑤
难度: 简单查看答案及解析
-
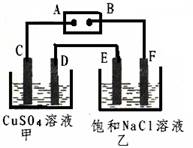
结合下图判断,下列叙述正确的是
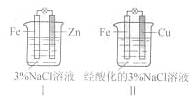
A.Ⅰ是验证牺牲阳极的阴极保护法的实验装置
B. Ⅰ和Ⅱ中负极反应均是Fe-2e-=Fe2+
C. Ⅰ和Ⅱ中正极反应均是O2+2H2O+4e-=4OH-
D. Ⅰ和Ⅱ中分别加入少量K3Fe(CN)6溶液,均有蓝色沉淀
难度: 简单查看答案及解析
-
常温下,下列叙述正确的是
A.某醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b
B.在滴有酚酞溶液的氨水中,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7
C.1.0×10-3mol/L盐酸的pH=3.0,1.0×10-8mol/L盐酸的pH=8.0
D.若1mLpH=1的盐酸与100 mL NaOH溶液混合后,溶液pH=7,则NaOH溶液pH=11
难度: 简单查看答案及解析
-
下列说法正确的是
A.25℃时,NH4Cl溶液的KW大于100℃时NH4Cl溶液的KW
B.25℃时,向10mL pH=3的醋酸溶液中加入水稀释后,溶液中
不变
C.25℃时,pH=12的氨水和pH=2的盐酸溶液等体积混合,c(Cl-)>c(NH4+)>c(H+)>c(OH-)
D.100℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液显中性
难度: 简单查看答案及解析
-
下列事实一定能说明HF是弱酸的是
①常温下NaF溶液的pH大于7 ②用HF溶液做导电性实验,灯泡很暗
③HF与NaCl不能发生反应 ④常温下0.1mol/L的HF溶液的pH为2.3
⑤HF能与Na2CO3溶液反应,产生CO2气体 ⑥HF与水能以任意比混溶
⑦1mol/L的HF水溶液能使紫色石蕊试液变红
A.①②⑦ B.②③⑤ C.③④⑥ D.①④
难度: 简单查看答案及解析
-
用惰性电极实现下列电解实验,其说法正确的是
A.电解稀硫酸溶液,实质上是电解水,故溶液的pH不变
B.电解稀氢氧化钠溶液,阳极消耗OH-,故溶液的pH减小
C.电解硫酸钠溶液,阴极和阳极析出产物的物质的量之比为2:1
D.电解氯化铜溶液,通电一段时间后,向溶液中加入适量的CuO或CuCO3均可使电解液恢复到起始状态
难度: 简单查看答案及解析
-
已知某可逆反应:mA(g)+nB(g)
xC(g) DH= Q kJ/mol ,在密闭容器中进行下图表示反应在不同时间t ,温度T和压强P与C在混合气体中的百分含量(C%)的关系曲线,则
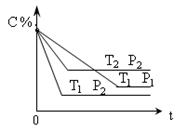
A.T1>T2 ,P1>P2 ,m+n>x ,Q>0
B.T1<T2 ,P1<P2 ,m+n<x ,Q<0
C.T1>T2 ,P1<P2 ,m+n<x ,Q<0
D.T1<T2 ,P1>P2 ,m+n>x ,Q<0
难度: 简单查看答案及解析
-
下列实验方法、结论合理的是
A.增加反应物的用量,化学反应速率一定加快
B.AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同
C.pH相同的两种一元酸HA溶液和HB溶液与足量Zn反应,HA比HB反应速率快,说明HA酸性更强
D.将碳酸钠溶液和碳酸氢钠溶液分别蒸干并灼烧,所得固体的成分均为碳酸钠
难度: 简单查看答案及解析