-
元素组成物质,下列说法不正确的是( )
A.构成地壳基本骨架的非金属元素的是O、Si
B.蛋白质中均含C、H、O、N四种元素
C.海水中的钠元素经过物理变化就可形成钠单质
D.火山喷发形成的物质中通常含有硫元素难度: 中等查看答案及解析
-
化学可以帮助人们形成对物质的科学认识,下列说法正确的是( )
A.蛋白质水解产物氨基酸可以合成人体所需蛋白质
B.糖类物质都有甜味,有甜味的物质都是糖类物质
C.蚕丝、羊毛和淀粉分别属于纤维素、蛋白质和多糖
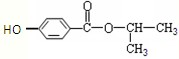
D.食品包装袋、食物保鲜膜等材料的主要成份是聚氯乙烯难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A.淀粉碘化钾试纸上滴稀硝酸变蓝:2I-+4H++NO3-=I2+NO↑+2H2O
B.用醋酸除去水垢:CaCO3+2H+=Ca2++H2O+CO2↑
C.向Mg(OH)2悬浊液中加入FeCl3溶液:3Mg(OH)2+2Fe3+⇌2Fe(OH)3+3Mg2+
D.向氯化铝溶液中滴加过量的氨水:Al3++4NH3•H2O=[Al(OH)4]-+4NH4+难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.应用盖斯定律,可计算某些难以直接测量的反应焓变
B.化学键的断裂与形成是化学反应中能量变化的主要原因
C.反应物能量高于生成物能量的反应是吸热反应
D.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件的△H相同难度: 中等查看答案及解析
-
下列叙述合理的是(以下操作均在25℃时进行)( )
A.将pH=4的盐酸稀释后,溶液中所有离子的浓度均降低
B.0.2mol•L-1盐酸与等体积0.05mol•L-1Ba(OH)2溶液混合后,溶液pH为1
C.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量不相同
D.使用广泛pH试纸测量CH3COONa溶液的pH=9.6难度: 中等查看答案及解析
-
某温度下2L密闭容器中,3种气体起始状态和平衡状态时的物质的量(n)如表所示.下列说法正确的是( )
X Y W (起始状态)/mol 2 1 (平衡状态)/mol 1 0.5 1.5
A.该温度下,此反应的平衡常数表达式是K=
B.升高温度,若W的体积分数减小,则此反应△H>0
C.增大压强,正、逆反应速率均增大,平衡向正反应方向移动
D.该温度下,再向容器中通入3molW,达到平衡时,n(X)=2mol难度: 中等查看答案及解析
-
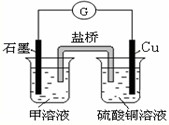
用碱性氢氧燃料电池为电源进行电解的实验装置示意图如图所示.下列说法中正确的是( )
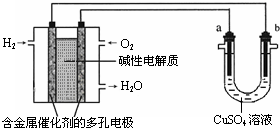
A.燃料电池工作时负极反应为:H2=2H++2e-
B.若要实现铁上镀铜,则a极是铁,b极是铜
C.若要实现电解精炼粗铜,则a极发生氧化反应,b极上有铜析出
D.a、b两极均是石墨时,在相同条件下当电池中消耗H222.4L(标准状况)时,a极析出铜64g难度: 中等查看答案及解析