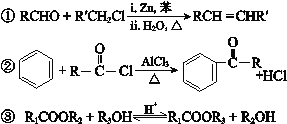-
下列说法中有明显错误的是( )
A. 对有气体参加的化学反应,增大压强(体系体积减小),可使单位体积内活化分子数增加,因而反应速率增大
B. 升高温度,一般可使活化分子的百分数增大,因而反应速率增大
C. 活化分子之间发生的碰撞一定为有效碰撞
D. 加入适宜的催化剂,可使活化分子的百分数大大增加,从而成千上万倍地增大化学反应的速率
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. “可燃冰”是将水变为油的新型燃料,具有热值高、无污染等优点
B. 淀粉、纤维素和油脂都是天然高分子化合物
C. N2(g)+3H2(g)
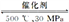 2NH3(g)采用高温、高压的条件有利于提高氨的产量
2NH3(g)采用高温、高压的条件有利于提高氨的产量D. 催化剂能够加快化学反应速率是由于其参与了化学反应并改变了反应的路径,使反应所需的活化能降低
难度: 中等查看答案及解析
-
氢气在氧气中燃烧产生蓝色火焰。已知破坏1molH-H键消耗的能量为Q1kJ,破坏1molO = O键消耗的能量为Q2kJ,形成1molH-O键释放的能量为Q3kJ。则下列关系式中正确的是
A. 2Q1+ Q2 > 4Q3 B. 2Q1+Q2<4Q3 C. Q1 +Q2 <Q3 D. Q1+Q2=Q3
难度: 中等查看答案及解析
-
一定条件下,2SO2(g)+O2(g)
2SO3(g) ΔH<0。下列有关叙述正确的是( )
A. 升高温度,v(正)变大,v(逆)变小
B. 恒温恒容,充入O2,O2的转化率升高
C. 恒温恒压,充入N2,平衡不移动
D. 恒温恒容,平衡前后混合气体的密度保持不变
难度: 中等查看答案及解析
-
含有11.2 g KOH的稀溶液与1 L 0.1 mol/L的H2SO4溶液反应,放出11.46 kJ的热量,表示该反应中和热的化学方程式为( )
A.KOH(aq)+H2SO4(aq)===K2SO4(aq)+H2O(l) Δ H=-11.46 kJ/mol
B.2KOH(aq)+H2SO4(aq)===K2SO4(aq)+2H2O(l) ΔH=-11.46 kJ/mol
C.2KOH(aq)+H2SO4(aq)===K2SO4(aq)+2H2O(l) ΔH=-114.6 kJ/mol
D.KOH(aq)+
H2SO4(aq)===K2SO4(aq)+H2O(l) ΔH=-57.3 kJ/mol
难度: 简单查看答案及解析
-
下列关于有机化合物的说法正确的是( )
A. 用系统命名法命名有机物
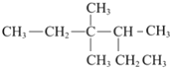 :3,3-二甲基-4-乙基戊烷
:3,3-二甲基-4-乙基戊烷B. 高聚物
的单体是
C. 有机物CH3CH=CH2不存在顺反异构现象
D. 可以利用质谱法鉴别二甲醚和乙醇
难度: 中等查看答案及解析
-
在密闭容器中发生反应aA(g)
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.7倍,下列叙述正确的是( )
A. A的转化率增大 B. 平衡向正反应方向移动
C. D的体积分数变大 D. a < c+d
难度: 中等查看答案及解析
-
在一定条件下,1mol N2和3mol H2混合后反应,达到平衡时测得混合气体的密度是同温同压下氢气的5倍,则氮气的转化率为( )
A. 20% B. 30% C. 40% D. 50%
难度: 中等查看答案及解析
-
除去下列物质中所含少量杂质,所选用的试剂和分离方法能达到实验目的是 ( )
混合物
(括号内为杂质)
试剂
(足量)
分离方法
A
苯(苯酚)
Na2CO3溶液
分液
B
乙烷(乙烯)
酸性KMnO4溶液
洗气
C
乙酸乙酯(乙酸)
NaOH溶液
分液
D
乙酸(乙醛)
新制Cu(OH)2
过滤
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
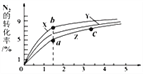
一定条件下,在容积不变的密闭容器中进行如下反应:NO(g)+ CO(g)
N2(g)+ CO2(g);△H=-373.2 kJ/mol。右图曲线a表示该反应过程中,NO的转化率与反应时间的关系。若改变起始条件,使反应过程按照曲线b进行,可采取的措施是( )
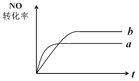
A. 加催化剂 B. 降低温度
C. 增大反应物中NO的浓度 D. 向密闭容器中加入氩气
难度: 中等查看答案及解析
-
已知CH4(g)+H2O(g)=CO(g)+3H2(g) △H= +206kJ / mol
CH4(g)+CO2(g)=2CO(g)+2H2 (g) △H= +247kJ / mol
C—H键的键能约为413 kJ / mol, O—H键的键能约为463 kJ / mol,H—H键的键能约为436 kJ / mol,则CO2中C=O键的键能约为
A.797.5 kJ / mol B.900.5 kJ / mol
C.962.5 kJ / mol D.1595 kJ / mol
难度: 中等查看答案及解析
-
2000K时,反应CO(g)+
O2 (g)
CO2 (g)的平衡常数为K,则相同温度下反应2CO2 (g)
2CO(g)+O2 (g)的平衡常数K'为( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
举办“人文奥运”的一个重要体现就是禁止运动员服用兴奋剂。有一种兴奋剂的结构简式如右式,下列有关该物质的说法正确的是
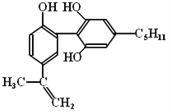
A. 该分子中所有碳原子可以稳定的共存在一个平面中
B. 1mol该物质与浓溴水和H2反应时,最多消耗Br2和H2的物质的量分别为4mol、7mol
C. 遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物
D. 滴入酸性KMnO4溶液,观察到紫色褪去,可证明分子中存在双键
难度: 中等查看答案及解析
-
下列热化学方程式正确的是
A.甲烷的燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为
CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B.500 ℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)
2NH3(g) ΔH=-38.6 kJ·mol-1
C.已知在101 kPa下,1 g H2燃烧生成水蒸气放出121 kJ热量,其热化学方程式为
H2(g)+
O2(g)===H2O(g) ΔH=-242 kJ·mol-1
D.25 ℃,101 kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ·mol-1,表示稀硫酸与氢氧化钾溶液反应的中和热的热化学方程式为H2SO4(aq)+2KOH(aq)=K2SO4(aq)+2H2O(l) ΔH=-114.6 kJ·mol-1
难度: 困难查看答案及解析
-
某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中P表示压强,T表示温度,n表示物质的量):
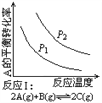
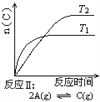
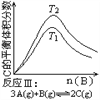

根据以上规律判断,下列结论正确的是( )
A. 反应Ⅰ:ΔH>0,P2>P1 B. 反应Ⅱ:ΔH<0,T1<T2
C. 反应Ⅲ:ΔH>0,T2>T1;或ΔH<0,T2<T1 D. 反应Ⅳ:ΔH<0,T2>T1
难度: 困难查看答案及解析
-
一定温度下,某气态平衡体系的平衡常数表达式为K=
 ,有关该平衡体系的说法正确的是( )
,有关该平衡体系的说法正确的是( )A. 升高温度,平衡常数K一定增大
B. 增大A浓度,平衡向正反应方向移动
C. 增大压强,C体积分数增加
D. 升高温度,若B的百分含量减少,则正反应是放热反应
难度: 中等查看答案及解析
-
可逆反应:2NO2
2NO+O2 在恒容密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n molO2的同时,生成2n molNO2
②单位时间内生成n molO2 的同时,生成2n mol NO
③用NO2、NO、O2 的物质的量浓度变化表示的反应速率的比为2 : 2 : 1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥ 混合气体的平均相对分子质量不再改变的状态
A. ①④⑥ B. ②③⑤ C. ①③④ D. ①②③④⑤⑥
难度: 困难查看答案及解析
-
已知NO2与N2O4可相互转化:2NO2(g)
N2O4(g) ΔH=-24.2 kJ·mol-1,在恒温下,将一定量NO2和N2O4的混合气体充入体积为2 L的密闭容器中,其中物质的量浓度随时间变化的关系如右图所示。下列推理分析不合理的是( )
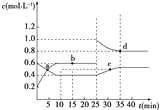
A. 前10 min内,用v(NO2)表示的反应速率为0.02 mol·L-1·min-1
B. 反应进行到10 min时,体系吸收的热量为9.68 kJ
C. b、d两点中v(正)与v(逆)均相等
D. 25 min时,正反应速率增大
难度: 困难查看答案及解析
-
已知:
(注:R、R′表示烃基),
属于酮类,酮不发生银镜反应。今有如下变化:A(C6H12O2)
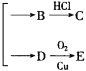 。已知C为羧酸,C、E都不发生银镜反应,则A的结构可能有
。已知C为羧酸,C、E都不发生银镜反应,则A的结构可能有A. 1种 B. 2种 C. 3种 D. 4种
难度: 困难查看答案及解析
-
在一个不导热的恒容密闭容器中通入CO(g)和H2O(g),一定条件下使反应CO(g)+H2O(g)
CO2(g)+H2(g)达到平衡状态,正反应速率随时间变化的示意图如下所示。由图可得出的正确结论是

A. 反应物浓度:a点小于c点
B. c点时反应进行的程度最大
C. 该反应的正反应为吸热反应
D. △t1=△t2时,生成H2的物质的量:a~b段小于b~c段
难度: 中等查看答案及解析